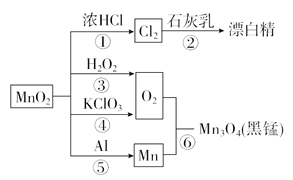
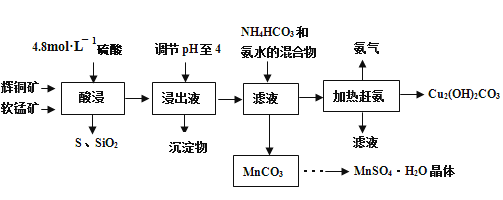
题目内容
【题目】碳酸锂广泛应用于陶瓷和医药等领域,在水中的溶解度比较小。以锂辉石(主要成分为Li2O,含有少量SiO2、Al2O3、Fe2O3)为原料制备Li2CO3的流程如下:
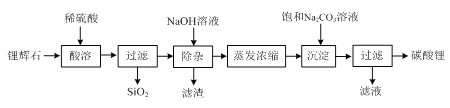
⑴ 写出“酸溶”时Li2O发生反应的离子方程式:________。
⑵ “除杂”时所用NaOH溶液不能过量,原因是________。
⑶ “除杂”时检验铁元素已完全除去的方法是________。
⑷ 写出“沉淀”时反应的化学方程式:________。
⑸ 检验最终所得碳酸锂样品中是否含有Na2CO3的方法是:________。
【答案】Li2O+2H+=2Li++H2O 若NaOH过量,Al(OH)3溶解生成NaAlO2 静置,取上层清液滴加KSCN溶液,溶液不显红色则铁元素已完全除去 Na2CO3+Li2SO4=Li2CO3↓+Na2SO4、 用洁净的铁丝(或铂丝)蘸取碳酸锂样品于酒精灯外焰上灼烧,若火焰呈黄色则含Na2CO3,反之则不含。
【解析】
锂辉石(主要成分为Li2O,含有少量SiO2、Al2O3、Fe2O3)加入稀硫酸,Li2O,Al2O3、Fe2O3转化为锂离子,铝离子,铁离子,SiO2与硫酸不反应,过滤后滤液中含有锂离子,铝离子,铁离子,加入氢氧化钠后,铝离子,铁离子分别生成氢氧化铝沉淀,氢氧化铁沉淀,过滤滤液中有锂离子,加入碳酸钠溶液产生碳酸锂沉淀。
(1)Li2O为碱性氧化物,与酸反应生成盐和水,发生反应的离子方程式:Li2O+2H+=2Li++H2O;
(2) “除杂”是为了将Fe3+和Al3+转化为Fe(OH)3和Al(OH)3除去,而Al(OH)3会溶于过量的碱,所用NaOH溶液不能过量,原因是氢氧化铝会与氢氧化钠反应生成偏铝酸钠,会引入新的杂质;
(3)“除杂”时检验铁元素已完全除去的方法是静置,取上层清液滴加KSCN溶液,溶液不显红色,则铁元素已完全除去;
(4)蒸发浓缩得到碳酸锂溶液,加入饱和的碳酸钠溶液发生的反应是Na2CO3+Li2SO4=Li2CO3↓+Na2SO4;
(5)碳酸锂中可能含有碳酸钠,检验的方法是焰色反应,具体是用洁净的铁丝(或铂丝)蘸取碳酸锂样品于酒精灯外焰上灼烧,若火焰呈黄色则含Na2CO3,反之则不含。

【题目】下列图示装置和对应实验原理的描述均正确的是
A | B | C | D |
|
|
|
|
根据温度计读数的变化测定浓硫酸和NaOH溶液反应的反应热 | 加热固体NaHCO3制备少量的Na2CO3 | 验证牺牲阳极的阴极保护法,可证明铁被保护 | 根据小试管中液面的变化可判断铁钉发生了析氢腐蚀 |
A. AB. BC. CD. D