题目内容
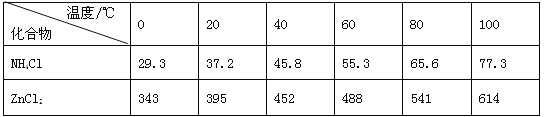
【题目】如图a酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是由碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,下列说法不正确的是
有关数据如下表所示:
图a 图b
A. 该电池的正极反应式为MnO2+eˉ+H+==MnOOH
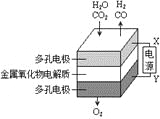
B. 利用干电池,高温电解H2O—CO2混合气体制备H2和CO,如图b,则阴、阳两极生成的气体的物质的量之比是1:1
C. 废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过重结晶方法分离
D. 废电池糊状填充物加水处理后所得滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,可以采用加热的方法
【答案】B
【解析】
A、正极得到电子,电极反应式为MnO2+eˉ+H+=MnOOH,A正确;
B、根据装置图可知阴极水、二氧化碳得到电子,生成氢气和CO。阳极是氧离子失去电子生成氧气,反应式为H2O+CO2![]() H2+CO+O2,因此阴、阳两极生成的气体的物质的量之比是2:1,B错误;
H2+CO+O2,因此阴、阳两极生成的气体的物质的量之比是2:1,B错误;
C、氯化锌和氯化铵的溶解度受温度的影响变化不同,两者可以通过重结晶方法分离,C正确;
D、在空气中加热时,碳粉、MnOOH可被氧化,分别生成二氧化碳和二氧化锰,所以欲从中得到较纯的二氧化锰,可以采用加热的方法,D正确;
答案选B。

练习册系列答案
相关题目