题目内容
【题目】市售一次性电池品种很多的,碱性锌锰电池的日常生活中用量很大。回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如下:
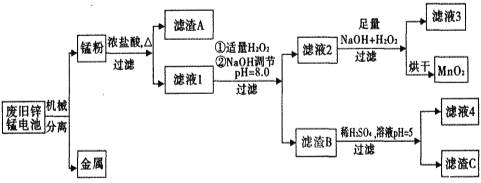
已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含量有少量铁盐和亚铁盐。常温下,生成氢氧化物沉淀的pH如下表。
物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2/Mn(OH)3 |
开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
完全沉淀pH (c≤1.0x10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
(1)加入NaOH溶液调节pH=8.0,目的是___。计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=___。
(2)写出滤液2中的Mn2+变成MnO2的离子方程式___。
(3)写出滤渣B与稀硫酸在pH=5时的化学方程式___。
(4)工艺中还可以将滤液4进行___、___、___、___、洗涤得到含结晶水的硫酸盐晶体。
(5)MnO2常用来制取KMnO4,在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4。电解K2MnO4溶液的总反应方程式___。
【答案】使Fe3+、Zn2+完全沉淀而除去 1.0×10-17 Mn2++H2O2+2OH-=MnO2↓+2H2O Zn(OH)2+H2SO4=ZnSO4+2H2O 蒸发浓缩 冷却 结晶 过滤 2K2MnO4+2H2O![]() 2KMnO4+2KOH+H2↑
2KMnO4+2KOH+H2↑
【解析】
废旧锌锰电池进行机械分离得到金属和锰粉;“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含量有少量铁盐和亚铁盐,锰粉与浓盐酸、加热,其中MnO2、MnOOH、Zn(OH)2反应得到MnCl2、ZnCl2,滤渣A中主要含碳粉,滤液1中含MnCl2、ZnCl2、铁盐和亚铁盐,向滤液1中加入少量双氧水,发生2Fe2++2H++H2O2=2Fe3++2H2O,加入NaOH溶液调节溶液pH=8.0,根据表中数据,Fe3+、Zn2+完全沉淀而除去;过滤后向滤渣B中加入稀硫酸并调节溶液的pH=5,过滤得到的滤渣C是Fe(OH)3,滤液4的主要成分是硫酸锌;向滤液2中加入足量NaOH和双氧水发生Mn2++H2O2+2OH-=MnO2↓+2H2O,过滤烘干得到固体MnO2。
(1)根据表中各离子开始沉淀和完全沉淀的pH,加入NaOH溶液调节pH=8.0,目的是使Fe3+、Zn2+完全沉淀而除去;常温下,Ksp[Zn(OH)2]=c2 (OH-)×c(Zn2+),Kw=c(OH-)×c(H+) ,Zn2+完全沉淀的pH=8.0,c(OH-)=![]() =10-6mol/L,Ksp[Zn(OH)2]= (10-6) 2×10-5=10-17;
=10-6mol/L,Ksp[Zn(OH)2]= (10-6) 2×10-5=10-17;
(2)滤液2中的Mn2+被双氧水氧化生成MnO2的同时生成水,反应的离子方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O;
(3)根据Fe3+、Zn2+开始沉淀和完全沉淀的pH,滤渣B中氢氧化锌与稀硫酸在pH=5时反应生成硫酸锌和水,化学方程式为Zn(OH)2+ H2SO4= ZnSO4+ 2H2O;
(4)滤液4为硫酸锌,从硫酸锌溶液中得到含有结晶水的ZnSO4,应将滤液4进行蒸发浓缩、冷却、结晶、过滤、洗涤的方法制取;
(5)电解K2MnO4溶液时,阳极上MnO42-失电子发生氧化反应得到MnO4-、阴极上氢离子放电生成氢气,总反应式为2K2MnO4+2H2O![]() 2KMnO4+2KOH+H2↑。
2KMnO4+2KOH+H2↑。

 初中暑期衔接系列答案
初中暑期衔接系列答案