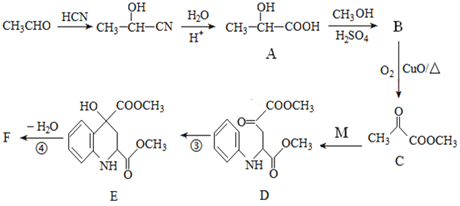
题目内容
【题目】下列关于苯的说法正确的是( )。
A.苯的分子式为![]() ,它不能使酸性
,它不能使酸性![]() 溶液褪色,属于饱和烃
溶液褪色,属于饱和烃
B.![]() 苯中含有的碳碳双键数为
苯中含有的碳碳双键数为![]()
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的化学键完全相同
【答案】D
【解析】
A.从苯的分子式![]() 看,其氢原子数未达到饱和,应属于不饱和烃,而苯不能使酸性
看,其氢原子数未达到饱和,应属于不饱和烃,而苯不能使酸性![]() 溶液褪色,是由于苯分子中的碳碳键是介于单键与双键之间的独特的键,故A错误;
溶液褪色,是由于苯分子中的碳碳键是介于单键与双键之间的独特的键,故A错误;
B.苯分子中的碳碳键是介于单键与双键之间的独特的键,并不是碳碳双键,故B错误;
C.在催化剂的作用下,苯与液溴反应生成溴苯,发生的是取代反应而不是加成反应,故C错误;
D.苯分子为平面正六边形结构,其分子中6个碳原子之间的化学键完全相同,故D正确;
故答案选D。

 期末1卷素质教育评估卷系列答案
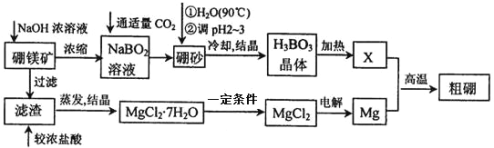
期末1卷素质教育评估卷系列答案【题目】市售一次性电池品种很多的,碱性锌锰电池的日常生活中用量很大。回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如下:
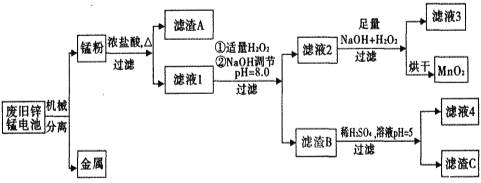
已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含量有少量铁盐和亚铁盐。常温下,生成氢氧化物沉淀的pH如下表。
物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2/Mn(OH)3 |
开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
完全沉淀pH (c≤1.0x10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
(1)加入NaOH溶液调节pH=8.0,目的是___。计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=___。
(2)写出滤液2中的Mn2+变成MnO2的离子方程式___。
(3)写出滤渣B与稀硫酸在pH=5时的化学方程式___。
(4)工艺中还可以将滤液4进行___、___、___、___、洗涤得到含结晶水的硫酸盐晶体。
(5)MnO2常用来制取KMnO4,在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4。电解K2MnO4溶液的总反应方程式___。
【题目】下列有关实验操作与相应结论都正确的是![]()
选项 | 实验操作及现象 | 实验结论 |
A | 取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润蓝色石蕊试纸变红. | 可证明晶体的成分中含有 |
B | Z、W两试管中分别盛有pH和体积相同的盐酸和醋酸溶液,同时分别投入质量大小、形状相同的少量锌粒,Z中产生气体速率快 | Z中盛放的是醋酸 |
C | 向尿液中加入新制 | 说明尿液中不含有葡萄糖 |
D | 某待测液先滴入氯水无明显现象,后滴入硫氰化钾溶液出现血红色 | 该待测液中一定含有 |
A.AB.BC.CD.D