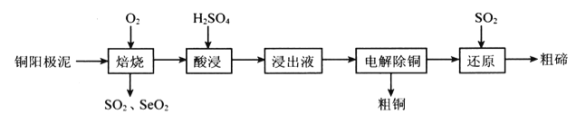
题目内容
【题目】一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷和氧气,电极反应为:C2H6+18OH--14e-=2CO32-+12H2O;7H2O+![]() O2+14e-=14OH-
O2+14e-=14OH-
有关此电池的推断错误的是( )
A.通乙烷的电极为负极
B.参加反应的O2与C2H6的物质的量之比为7:2
C.放电一段时间后,KOH的物质的量浓度将下降
D.在电解质溶液中CO32-向正极移动
【答案】D
【解析】
A.通入燃料的电极是负极、通入氧气的电极是正极;
B.根据得失电子相等确定氧化剂和燃料的物质的量之比;
C.其电池反应式为C2H6+4OH-+![]() O2=2CO32-+5H2O,KOH的物质的量减少、溶液体积增大;
O2=2CO32-+5H2O,KOH的物质的量减少、溶液体积增大;
D.放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动。
A.在燃料电池中,燃料失电子发生氧化反应、氧化剂得电子发生还原反应,所以通入燃料的电极是负极、通入氧化剂的电极是正极,A正确;
B.电池反应式为C2H6+4OH-+![]() O2=2CO32-+5H2O,则参加反应的氧气与C2H6的物质的量之比为7:2,B正确;
O2=2CO32-+5H2O,则参加反应的氧气与C2H6的物质的量之比为7:2,B正确;
C.电池反应式为C2H6+4OH-+![]() O2=2CO32-+5H2O,KOH的物质的量减少、溶液体积增大,所以KOH的物质的量浓度减小,C正确;
O2=2CO32-+5H2O,KOH的物质的量减少、溶液体积增大,所以KOH的物质的量浓度减小,C正确;
D.放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,所以碳酸根离子向负极移动,D错误;
故合理选项是D。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】下表为元素周期表的一部分,a、b、c……为部分元素。回答下列问题:
a | |||||||||||||||||
f | h | i | |||||||||||||||
b | e | j | |||||||||||||||
c | d | g | k | ||||||||||||||
l | |||||||||||||||||
(1)请写出d元素的原子结构示意简图:___________________________________;
(2)请写出i的单质与a、h形成的化合物发生反应的化学方程式_______________________;
(3)请写出上述元素组成的物质间发生的与“(2)”反应类型相同且有固体非金属单质生成的化学反应方程式________________________________________________;
(4)g、e两种元素的最高价氧化物对应的水合物的化学性质相似,请写出g元素最高价氧化物对应的水合物与a、c、h三种元素形成的化合物反应的离子方程式:______________________________________________________;
(5)j、k、l三种元素之间能以原子个数比1∶1两两形成互化物,这些互化物的性质类似于这些元素单质的性质。请写出j、k的互化物与c、l形成的化合物等物质的量反应时的化学方程式________________。
(6)用电子式表示c、h两种元素以原子个数比1:1形成化合物的形成过程:______________________________________________________。