题目内容
【题目】在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)800 ℃,反应达到平衡时,NO的物质的量浓度是________。

(2)如图中表示NO2的变化的曲线是________。用NO2表示从0~2s内该反应的平均速率v=________。
(3)能说明该反应已达到平衡状态的是________。
a. v(NO2)=2v(O2) b. 容器内压强保持不变
c. 2v逆(NO)=v正(O2) d. 容器内气体的平均摩尔质量保持不变
(4)能使该反应的反应速率增大的是________。
a. 及时分离出NO2气体 b. 适当升高温度
c. 增大O2的浓度 d. 选择高效催化剂
【答案】0.0035 mol/L b 3.0×10-3 mol/(L·s) b、d bcd
【解析】
(1)由表格数据可知,3s后物质的量不再变化,达到平衡状态,结合c=![]() 计算;
计算;
(2)根据一氧化氮物质的量的变化知,该反应向正反应方向移动,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量;根据v=![]() 计算一氧化氮的反应速率,再结合同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比计算NO2的反应速率;
计算一氧化氮的反应速率,再结合同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比计算NO2的反应速率;
(3)结合平衡的特征分析判断是否为平衡状态;
(4)根据浓度、压强、催化剂等对反应速率的影响分析判断。
(1)由表格数据可知,3s后物质的量不再变化,达到平衡状态,NO的物质的量浓度是![]() =0.0035mol/L,故答案为:0.0035mol/L;
=0.0035mol/L,故答案为:0.0035mol/L;
(2)根据一氧化氮物质的量的变化知,该反应向正反应方向进行,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量,所以表示NO2的变化的曲线是b,
0~2s内v(NO)= =0.0030mol/(L·s),同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(NO2)= v(NO)=0.003mol/(Ls),故答案为:b;0.003mol/(Ls);
=0.0030mol/(L·s),同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(NO2)= v(NO)=0.003mol/(Ls),故答案为:b;0.003mol/(Ls);
(3)a.v(NO2)=2v(O2)始终存在,不能判定平衡状态,故a不选;b.反应后气体的物质的量逐渐减小,则容器内压强逐渐减小,当压强保持不变,说明达到平衡状态,故b选;c.2v逆(NO)=v正(O2),说明正反应速率大于逆反应速率,不是平衡状态,故c不选;d.容器内气体的质量不变、物质的量逐渐减小,则气体的平均摩尔质量逐渐增大,当气体的平均摩尔质量保持不变,说明达到平衡状态,故d选;故答案为:bd;
(4)a.及时分离出NO2气体,正反应速率减小,故a不选;b.适当升高温度,反应速率增大,故b选;c.增大O2的浓度,反应物浓度增大,反应速率加快,故c选;d.选择高效催化剂,反应速率加快,故d选;故答案为:bcd。

【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如下所示。
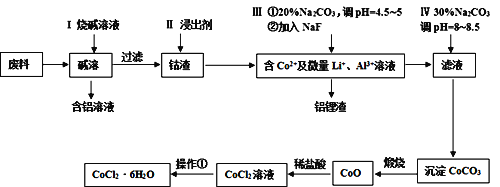
请回答下列问题:
(1)步骤I中主要发生的化学反应方程式为______。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果是_______。
(3)步骤Ⅲ中①的目的是除去Al3+,写出该步反应的离子方程式______。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_____、过滤、洗涤、干燥。洗涤过程中可以用工业酒精代替水,其优点是_____。
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是____(填选项,忽略亚钴离子的颜色干扰)
A.KCl B.KSCN C.K2CrO4 D.K2S
已知几种物质在20℃时的颜色及Ksp值如下表
化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 1.0×10-12 | 2.0×10-48 | 2.0×10-12 |