题目内容
1.实验室中所用少量氯气是用下列方法制取的:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$=Cl2↑+MnCl2+2H2O(1)该反应既是离子反应也是氧化还原反应.该反应的还原剂是HCl(用化学式表示).氯气有毒会污染空气,实验室常用氢氧化钠吸收该实验的尾气,写出用氢氧化钠溶液吸收氯气的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(2)若有17.4gMnO2与足量的浓盐酸充分反应后,所得溶液的体积为500mL.求:
①转移电子数为0.4NA;
②被氧化的HCl的物质的量0.4 mol.
分析 (1)该反应中Cl元素化合价由-1价变为0价、Mn元素化合价由+4价变为+2价,失电子的物质是还原剂;氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水.
(2)17.4gMnO2的物质的量=$\frac{17.4g}{87g/mol}$=0.2mol,
①根据二氧化锰和转移电子之间的关系式计算;
②根据二氧化锰和作还原剂的HCl之间的关系式计算.
解答 解:(1)该反应中Cl元素化合价由-1价变为0价、Mn元素化合价由+4价变为+2价,失电子的物质是还原剂,所以HCl作还原剂;氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,其反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:HCl;Cl2+2OH-=Cl-+ClO-+H2O;
(2)17.4gMnO2的物质的量=$\frac{17.4g}{87g/mol}$=0.2mol,
①根据二氧化锰和转移电子之间的关系式知,转移电子个数=0.2mol×(4-2)×NA/mol=0.4 NA,故答案为:0.4 NA;
②该反应中二氧化锰和被氧化的HCl的物质的量之比为1:2,有0.2mol二氧化锰参加反应,则有0.4molHCl被氧化,故答案为:0.4.
点评 本题考查了氧化还原反应及其有关计算、离子方程式的书写,知道常见元素化合价,根据方程式中各个物理量之间的关系式计算即可,知道离子方程式的书写规则,题目难度不大.

练习册系列答案
相关题目
9.二甘醇可用作溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命.二甘醇的结构简式是HO-CH2CH2-O-CH2CH2-OH.下列有关二甘醇的叙述正确的是( )
| A. | 不能发生消去反应 | B. | 能发生取代反应 | ||
| C. | 能溶于水,不溶于乙醇 | D. | 不能氧化为醛 |
16.将含有0.4molCuSO4和0.4molNaCl的水溶液1L,用惰性电极电解一段时间后,在一个电极上得到0.3mol铜,在另一电极上析出的气体在标准状况下的体积是( )
| A. | 5.6L | B. | 6.75L | C. | 13.44L | D. | 11.2L |
6.下列说法正确的是( )
| A. | 人工可以将石墨转化为金刚石,该变化是物理变化 | |
| B. | 氯、钠、镁、锂都是海水中重要的常量元素 | |
| C. | 金刚石、石墨石和C60是碳元素的同素异形体,它们的物理性质差别很大,是因为他们各自的原子排列不同 | |
| D. | 硫单质俗称硫黄,通常状况下是一种易溶于酒精,不溶于水的淡黄色固体 |
13.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| B. | 0.1 mol•L-1FeCl3溶液:K+、NH4+、I-、OH- | |
| C. | 8 mol•L-1HNO3的溶液:Fe2+、H+、Cl-、Na+ | |
| D. | 0.1 mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- |
10.下列有关化学用语表示正确的是( )
| A. | NaCl的电子式: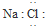 | |
| B. | 氟原子的结构示意图: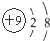 | |
| C. | 中子数为20的氯原子:1720Cl | |
| D. | 碳酸钠的电离方程式:Na2CO3=Na++CO32- |
11.下列名词和有机物无关的是( )
| A. | 过氧乙酸 | B. | 烟碱 | C. | 硬水 | D. | 光化学烟雾 |
 .
.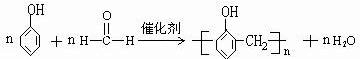 .
.