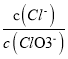题目内容
【题目】硫酸亚铁铵(NH4)aFeb(SO4)cdH2O又称莫尔盐,是浅绿色晶体。用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:FeS2 + 14Fe3+ + 8H2O =15Fe2+ + 2SO42— + 16H+
(1)写出“还原”时Fe3+与FeS2发生还原反应Ⅱ的离子方程式:______。实验室检验“还原”已完全的方法是_______________。
(2) “还原”前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
离子 | 离子浓度(mol·L-1) | |
还原前 | 还原后 | |
SO42- | 3.20 | 3.40 |
Fe2+ | 0.05 | 2.15 |
请计算反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比______。
(3)称取11.76g新制莫尔盐,溶于水配成250mL溶液。取25.00 mL该溶液加入足量的BaCl2溶液,得到白色沉淀1.398 g;另取25.00 mL该溶液用0.0200 mol/L KMnO4酸性溶液滴定,当MnO4-恰好完全被还原为Mn2+时,消耗溶液的体积为30.00mL。试确定莫尔盐的化学式_________________(请写出计算过程)。
【答案】 FeS2 +2Fe3+ = 3Fe2++2S↓ 取少量酸浸后的溶液,向其中滴加数滴KSCN溶液,如果溶液变红则“还原”未完全,反之,已完全 7:2 原样品中的n(SO42-)=10×1.398g÷233g/mol=0.06mol , n(MnO4-)=0. 0200mol/L×0.03L=0.000 6 mol ,由得失电子守恒可知:n(Fe2+)=5 n(MnO4-)=0.003mol ,原样品中n(Fe2+)=0.03 mol , 由电荷守恒可知:原样品中n(NH4+)=0. 06mol 由质量守恒:n(H2O)=0.18 mol ,故化学式为: (NH4)2Fe(SO4)26H2O或 (NH4)2SO4FeSO46H2O
【解析】本题主要考查对于“用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程”的评价。涉及Fe3+的氧化性等。
(1)“还原”时Fe3+与FeS2发生还原反应Ⅱ生成S,反应的离子方程式:FeS2 +2Fe3+ = 3Fe2++2S↓。实验室检验“还原”已完全就是检验Fe3+不存在,方法是取少量酸浸后的溶液,向其中滴加数滴KSCN溶液,如果溶液变红则“还原”未完全,反之,已完全。
(2) “还原”前后溶液中c(Fe2+)的变化为2.10mol/L,c(![]() )的变化为0.20mol/L,对应反应I的c(Fe2+)的变化为1.50mol/L,其中还原而成Fe2+的浓度c(Fe2+)为1.40mol/L,反应II的c(Fe2+)的变化为(2.10-0.15)mol/L=0.60mol/L,其中还原而成Fe2+的浓度c(Fe2+)为0.40mol/L,所以反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比1.40:0.40=7:2。
)的变化为0.20mol/L,对应反应I的c(Fe2+)的变化为1.50mol/L,其中还原而成Fe2+的浓度c(Fe2+)为1.40mol/L,反应II的c(Fe2+)的变化为(2.10-0.15)mol/L=0.60mol/L,其中还原而成Fe2+的浓度c(Fe2+)为0.40mol/L,所以反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比1.40:0.40=7:2。
(3)原样品中n(SO42-)=10×1.398g÷233g/mol=0.06mol,n(MnO4-)=0.0200mol/L×0.03L=0.0006mol,由得失电子守恒可知:n(Fe2+)=5n(MnO4-)=0.003mol,原样品中n(Fe2+)=0.03 mol,由电荷守恒可知:原样品中n(NH4+)=0.06mol,由质量守恒得:n(H2O)=0.18mol,得出化学式为: (NH4)2Fe(SO4)26H2O或(NH4)2SO4FeSO46H2O。

 金状元绩优好卷系列答案
金状元绩优好卷系列答案