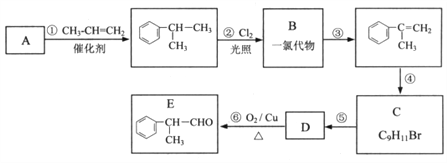
题目内容
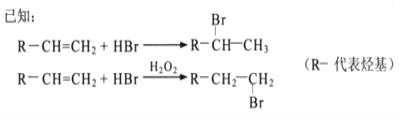
【题目】已知: 将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KC1O3,且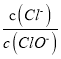 与温度高低有关。当n(KOH)=amol 时,下列有关说法错误的是
与温度高低有关。当n(KOH)=amol 时,下列有关说法错误的是
A. 若某温度下,反应后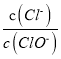 =11,则溶液中
=11,则溶液中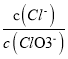 =
=![]()
B. 参加反应的氯气的物质的量等于![]() amol
amol
C. 改变温度,产物中KC1O3的最大理论产量为![]() amol
amol
D. 改变温度,反应中转移电子的物质的量n的范围: ![]() amol≤n≤
amol≤n≤![]() amol
amol
【答案】C
【解析】A.令n(ClO-)=1mol,反应后c(Cl-):c(ClO-)=11,则n(Cl-)=11mol,电子转移守恒,5×n(ClO3-)+1×n(ClO-)=1×n(Cl-),即5×n(ClO3-)+1×1mol=1×11mol,解得n(ClO3-)=2mol,故溶液中![]() =
=![]() ,故A正确;B.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH),故参加反应的氯气的物质的量=
,故A正确;B.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH),故参加反应的氯气的物质的量=![]() n(KOH)=
n(KOH)= ![]() amol,故B正确;C.氧化产物只有KClO3时,其物质的量最大,由C中计算可知:n最大(KClO3)=
amol,故B正确;C.氧化产物只有KClO3时,其物质的量最大,由C中计算可知:n最大(KClO3)= ![]() n(KOH)=
n(KOH)= ![]() a mol,故C错误;D.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n(KClO3)=
a mol,故C错误;D.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n(KClO3)= ![]() n(KOH)=
n(KOH)= ![]() a mol,转移电子最大物质的量=
a mol,转移电子最大物质的量=![]() a mol×5=
a mol×5=![]() a mol,氧化产物只有KClO时,转移电子最少,根据电子转移守恒n(KCl)=n(KClO),由钾离子守恒:n(KCl)+n(KClO)=n(KOH),故n(KClO)=
a mol,氧化产物只有KClO时,转移电子最少,根据电子转移守恒n(KCl)=n(KClO),由钾离子守恒:n(KCl)+n(KClO)=n(KOH),故n(KClO)= ![]() n(KOH)=
n(KOH)= ![]() amol,转移电子最小物质的量=
amol,转移电子最小物质的量=![]() amol×1=
amol×1=![]() amol,故反应中转移电子的物质的量n的范围:
amol,故反应中转移电子的物质的量n的范围: ![]() amol≤n≤
amol≤n≤![]() amol,故D正确;故选C。
amol,故D正确;故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】硫酸亚铁铵(NH4)aFeb(SO4)cdH2O又称莫尔盐,是浅绿色晶体。用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:FeS2 + 14Fe3+ + 8H2O =15Fe2+ + 2SO42— + 16H+
(1)写出“还原”时Fe3+与FeS2发生还原反应Ⅱ的离子方程式:______。实验室检验“还原”已完全的方法是_______________。
(2) “还原”前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
离子 | 离子浓度(mol·L-1) | |
还原前 | 还原后 | |
SO42- | 3.20 | 3.40 |
Fe2+ | 0.05 | 2.15 |
请计算反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比______。
(3)称取11.76g新制莫尔盐,溶于水配成250mL溶液。取25.00 mL该溶液加入足量的BaCl2溶液,得到白色沉淀1.398 g;另取25.00 mL该溶液用0.0200 mol/L KMnO4酸性溶液滴定,当MnO4-恰好完全被还原为Mn2+时,消耗溶液的体积为30.00mL。试确定莫尔盐的化学式_________________(请写出计算过程)。