题目内容
【题目】甲醇是一种重要的化工原料,又是一种可再生资源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________。
②在上述制备甲醛时,常向反应器中通入适当过量的氧气,其目的是_________________。
(2)工业上可用如下方法合成甲醛,化学方程式为CO(g)+2H2(g)=CH3OH(g),已知某些化学键的键能数据如下表:
化学键 | C-C | C-H | H-H | C-O | C=O | O-H |
键能/kJ/mol | 348 | 413 | 436 | 358 | x | 463 |
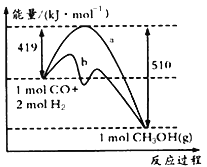
请回答下列问题:
①如图中曲线a到曲线b的措施是_______________。
②已知CO中的C与O之间为三键,其键能为xkJ/mol,则x=___________。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池正极的电极反应式为____________________。
②若以该电池为电源,用石墨作电极电解200mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl- | SO42- |
c/mol/L | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶液现象)阳极上收集到氧气的质量为_____________。
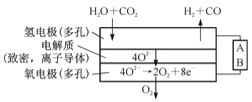
(4)电解水蒸气和CO2产生合成气(H2+CO),较高温度下(70-1000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由右图可知A为直流电源的 (填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:____________。
【答案】(1)①2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) △H=-316 kJ·mol-1
②提高甲醇的转化率(2分)
(2)①使用 加入催化剂 ②1097(3)①O2+2H2O -4e-=4OH-②3.2 g
(4)H2O+2e-=H2↑+O2-
【解析】
试题分析:(1)①已知:⑴CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ/mol
⑵2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
根据盖斯定律可知⑴×2+⑵即可得到CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式为2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) △H=-316 kJ·mol-1。
②向反应器中通入适当过量的氧气,使平衡向正反应方向进行,提高甲醇的转化率。
(2)①图中曲线a到曲线b降低了反应的活化能,其其措施是加入了催化剂。
②反应热=反应物中键能之和-生成物中键能之和,则根据方程式可知x+2×436-3×413-358-463=419-510,解得x=1097。
(3)①电池正极得到电子,则正极是氧气放电,其电极反应式为O2+2H2O -4e-=4OH-。
②电解一段时间后,两极收集到相同体积(相同条件下)的气体,这说明阴极上除了铜离子放电外,还有氢离子放电,铜离子的物质的量是0.1mol,设气体的物质的量是xmol,则根据电子得失守恒可知0.1×2+2x=4x,解得x=0.1,所以氧气的质量=0.1mol×32g/mol=3.2g。
(4)A电极产生氢气和CO,所以该电极是阴极,因此A电极是负极,水得到电子产生氢气的电极反应式为H2O+2e-=H2↑+O2- 。