题目内容
20.为预防“H1N1”甲型流感,同学们每天用“84”消毒液(NaClO溶液)消毒,下列说法正确的是( )| A. | NaClO溶液的漂白原理与SO2相同 | |
| B. | 1 mol Cl2与足量NaOH溶液反应转移2 mol电子 | |
| C. | NaClO溶液的消毒原理是其强氧化性使蛋白质变性 | |
| D. | “84”消毒液与“洁厕灵”(盐酸)共同使用可达到既清洁又消毒的双重效果 |
分析 A、NaClO的漂白原理为氧化漂白,SO2的漂白原理为化合漂白;
B、1mol氯气和足量氢氧化钠溶液反应发生自身氧化还原,氯元素化合价0价变化为-1价和+1价;
C、NaClO水解生成的次氯酸具有氧化性,可以使蛋白质变性;
D、“84”消毒液为NaClO溶液与“洁厕灵”(盐酸)混合会发生反应,ClO-+Cl-+2H+=Cl2↑+H2O生成有毒气体氯气;
解答 解:A、因NaClO的漂白原理为氧化漂白,SO2的漂白原理为化合漂白,故A错误;
B、Cl2+2NaOH=NaCl+NaClO+H2O,Cl2从0价变为+1或者-1价,所以1molCl2与足量NaOH溶液反应只转移了1mol电子,故B错误;
C、NaClO水解生成的次氯酸具有氧化性,NaClO溶液的消毒原理是其强氧化性使蛋白质变性,故C正确;
D、因“84”消毒液中含有NaClO,洁厕灵中含有盐酸,两者相遇发生反应:ClO-+Cl-+2H+=Cl2↑+H2O,产生有毒的氯气,故D错误;
故选C.
点评 本题主要考查了氧化还原反应知识,难度不大,试题有一定的灵活性,应注意知识的运用.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
10.一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:2SO2(g)+O2(g)?2SO3(g);△H=-akJ•mo1-2在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是( )
| A. | 4 mo1SO2和2mol O2 | B. | 4mol SO2、2mo1 O2和2mol SO3 | ||
| C. | 4mol SO2和4 mo1 O2 | D. | 6mo1 SO2和4 mo1 O2 |
11.从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是( )
| A. | 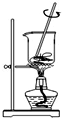 将海带灼烧成灰 | B. | 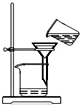 过滤得含I-溶液 | ||
| C. | 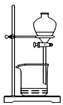 萃取后分层碘的CCl4溶液 | D. | 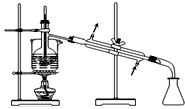 分离碘并回收CCl4 |
9.把4.48L CO2通过一定量的固体过氧化钠后收集到3.36L气体(标准状况下),则这3.36L气体的质量为( )
| A. | 3.8g | B. | 4.8g | C. | 5.6g | D. | 6.0g |
11.为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是( )
| 物质 | 试剂 | 分离方法 | |
| A | 硝酸钾(氯化钠) | 蒸馏水 | 降温结晶、过滤 |
| B | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| C | 苯(硝基苯) | / | 蒸馏 |
| D | 苯(苯酚) | 浓溴水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
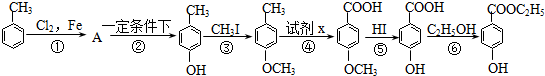
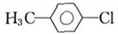 .
.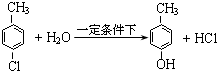 .
.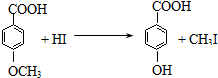 .
. 根据如图原电池的装置图回答下列问题:
根据如图原电池的装置图回答下列问题: .
.