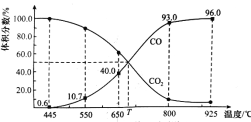
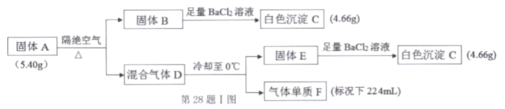
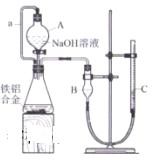
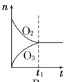
题目内容
【题目】N、F、Cu及其化合物在化工、医药、材料等方面应用十分广泛。回答下列有关问题:
(1)N原子中最高能级的电子的电子云轮廓图为___________;基态Cu+的核外电子排布式为____________。
(2)化合物(CH3)3N可用于制备医药、农药。分子中N原子杂化方式为________,该物质能溶于水的原因是_____________________。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,其阳离子的空间构型为_____________,写出一种与[H2F]+互为等电子体的分子______________(写化学式)。
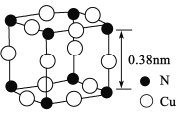
(4)氮、铜形成的一种化合物的晶胞结构如图所示。与每个Cu原子紧邻的Cu原子有____个,令阿伏加德罗常数的值为NA,该晶体的密度为______g/cm3。(列出计算式)
【答案】哑铃形或纺锤形 [Ar]3d10或1s22s22p63s23p63d10 sp3 (CH3)3N为极性分子,且可与水分子形成分子间氢键 V形 H2O或H2S 8 
【解析】
根据N原子的核外电子排布式判断最高能级的电子的电子云轮廓图。根据基态铜原子的核外电子排布式写出基态Cu+的核外电子排布式。根据价层电子对数判断杂化类型,根据分子结构判断易溶于水的原因。根据价层电子对互斥理论判断分子的立体构型,根据同族替换或等量代换找出等电子体。根据晶胞结构分析化学式并进行计算。
(1)N原子的核外电子排布式为1s22s22p3,最高能级的电子为2p上的电子,电子云轮廓图为哑铃形或纺锤形;基态铜原子的核外电子排布式为[Ar]3d104s1或1s22s22p63s23p63d104s1,Cu+是基态铜原子失去最外层的一个电子得到的,Cu+的核外电子排布式为[Ar]3d10或1s22s22p63s23p63d10;
(2)化合物(CH3)3N分子中N原子与三个甲基形成了3对共用电子对,N上还有一对孤电子对,价层电子对数为4,杂化方式为sp3,(CH3)3N为极性分子,且可与水分子形成分子间氢键,故易溶于水;
(3)[H2F]+中F上的孤电子对数为![]() ,价层电子对数为2+2=4,VSEPR模型为四面体型,分子的空间构型为V形,与[H2F]+互为等电子体的分子为H2O或H2S;
,价层电子对数为2+2=4,VSEPR模型为四面体型,分子的空间构型为V形,与[H2F]+互为等电子体的分子为H2O或H2S;
(4)图中与每个Cu原子紧邻的Cu原子有8个,铜原子和氮原子的个数分别为![]() 、
、![]() ,该晶体的密度为
,该晶体的密度为 g/cm3。
g/cm3。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案