题目内容
【题目】二甲醚(CH3OCH3)是一种新型能源,被誉为“21世纪的清洁燃料”。
(1)用CO和H2合成二甲醚的反应为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)△H。
CH3OCH3(g)+CO2(g)△H。
几种物质的相对能量如下:

△H=______kJ·mo1。改变下列“量”,一定会引起△H发生变化的是_____(填代号)。
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
(2)有利于提高反应中CH3OCH3产率的条件为_______(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
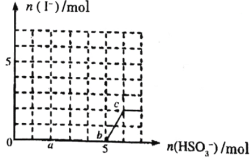
(3)采用新型催化剂(主要成分是Cu—Mn的合金)制备二甲醚。催化剂中n(Mn)/n(Cu)对合成二甲醚的影响情况如下图所示。

当n(Mn)/n(Cu)=2时,二甲醚的选择性(![]() )为85.8%,此时二甲醚的产率为_________。
)为85.8%,此时二甲醚的产率为_________。
(4)用二甲醚燃料电池电解法可将酸性含铬废水(主要含有Cr2O72-)转化为Cr3+。原理如下图:
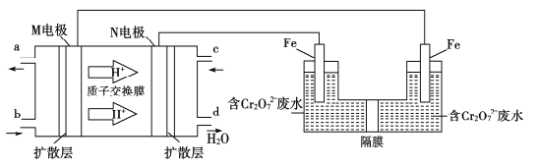
①燃料电池中的负极是______(填“M”或“N”)电极。电解池阴极的电极反应式为______________________________。
②消耗6.9g二甲醚时可处理Cr的含量为26.0g·L-1的废水1L,该套装置的能量利用率为___________。(保留3位有效数字)
【答案】-253.4 D B 61.8% M Cr2O![]() +6e-+14H+===2Cr3++7H2O 83.3%
+6e-+14H+===2Cr3++7H2O 83.3%
【解析】
根据反应热△H=生成物总能量-反应物总能量进行计算;根据影响化学平衡移动因素进行分析;根据二甲醚的选择性计算公式:![]() 进行计算;根据氢离子移动方向判断正负极,根据电子守恒计算能量的利用率。
进行计算;根据氢离子移动方向判断正负极,根据电子守恒计算能量的利用率。
(1)用CO和H2合成二甲醚的反应为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)△H=生成物总能量-反应物总能量=1453.0 kJ·mo1-1-(3
CH3OCH3(g)+CO2(g)△H=生成物总能量-反应物总能量=1453.0 kJ·mo1-1-(3![]() 285.8kJ·mo1-1+3
285.8kJ·mo1-1+3![]() kJ·mo1-1)=-253.4 kJ·mo1-1;
kJ·mo1-1)=-253.4 kJ·mo1-1;
A.改变温度会影响化学反应平衡移动,但不会影响△H,故 A不符合题意;
B.改变反应物浓度,影响化学反应平衡移动,但不会影响△H ,故 B不符合题意;
C.催化剂只改变化学反应速率,不会影响△H,故C不符合题意;
D.反应热与化学反应计量数成正比,所以改变化学计量数会影响△H,故 D符合题意;
故答案:-253.4;D;
(2) 根据3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)△H=-253.4 kJ·mo1-1可知,升高温度,平衡逆向移动,CH3OCH3产率降低,降低温度,平衡正向移动,CH3OCH3产率升高;增大压强,平衡正向移动,CH3OCH3产率升高,降低压强,平衡逆向移动,CH3OCH3产率降低;所以有利于提高反应中CH3OCH3产率的条件为低温高压,故B正确;故答案:B。
CH3OCH3(g)+CO2(g)△H=-253.4 kJ·mo1-1可知,升高温度,平衡逆向移动,CH3OCH3产率降低,降低温度,平衡正向移动,CH3OCH3产率升高;增大压强,平衡正向移动,CH3OCH3产率升高,降低压强,平衡逆向移动,CH3OCH3产率降低;所以有利于提高反应中CH3OCH3产率的条件为低温高压,故B正确;故答案:B。
(3) 当![]() =2时,二甲醚的选择性(
=2时,二甲醚的选择性(![]() )为85.8%,由图可知CO的转化率为72%,此时二甲醚的产率=85.8%
)为85.8%,由图可知CO的转化率为72%,此时二甲醚的产率=85.8%![]() =61.8%,故答案:61.8%;
=61.8%,故答案:61.8%;
(4)①由质子交换膜中氢离子移动方向可知,M为负极,N为正极;电解池中与正极相连为阳极发生氧化反应,与负极相连的极为阴极发生还原反应,所以反应的电极反应式为:Cr2O![]() +6e-+14H+===2Cr3++7H2O,故答案:M;Cr2O
+6e-+14H+===2Cr3++7H2O,故答案:M;Cr2O![]() +6e-+14H+===2Cr3++7H2O;
+6e-+14H+===2Cr3++7H2O;
②n(CH3OCH3)=![]() ,根据 电子守恒:CH3OCH3 - 12e-+3H2O= 2CO2↑+12H+可知转移电子为
,根据 电子守恒:CH3OCH3 - 12e-+3H2O= 2CO2↑+12H+可知转移电子为![]() 12,可以还原m(Cr)=26.0g·L-1
12,可以还原m(Cr)=26.0g·L-1![]() 1L=26.0g,根据Cr2O
1L=26.0g,根据Cr2O![]() +6e-+14H+===2Cr3++7H2O可知转移的电子=
+6e-+14H+===2Cr3++7H2O可知转移的电子=![]() =1.5mol,该套装置的能量利用率=
=1.5mol,该套装置的能量利用率=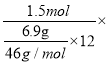 100%=83.3%,故答案为: 83.3%。
100%=83.3%,故答案为: 83.3%。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案