题目内容
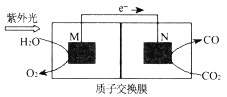
【题目】I.由三种元素组成的化合物A,式量在200- -300之间。在一 定条件下A能发生如下图的转化,其中B的焰色反应为紫色(透过蓝色钴玻璃),C是不溶于酸的白色沉淀。

请回答∶
(1) C的化学式是______,组成A的三种元素是________。
(2) A加热分解的化学方程式是_____。
(3) E可以和SCl2反应生成一种常用于有机合成的物质SOCl2和另一种常见气体,反应的化学方程式是________。
II.实验室测定某铁铝合金中的铝含量,利用如图装置和试剂完成。

请回答∶
(1)下列有关该实验的说法中正确的是_______。
A.由于恒压分液漏斗的存在,该装置不能进行气密性检查
B.读数前需将量气管C上下移动使B、C中的液面相平
C.反应完成后生成的氢气都要转移至装置B中
D.需要控制NaOH的量以防止产生气体过多超过量气装置的量程
(2)若将恒压分液漏斗(A) 去掉导管a,改成普通分液漏斗,则测得铁铝合金中的铝含量______,(填“偏大”、“偏小”或“不变”),请说明理由_____。
【答案】BaSO4 K、S、O 2K2S2O8 2K2SO4+2SO3↑+O2↑ SO3+SCl2= SOCl2+ SO2 B 偏大 滴入锥形瓶中的液体排开的气体使量气装置中气体体积增大,导致计算的铝含量增多。
2K2SO4+2SO3↑+O2↑ SO3+SCl2= SOCl2+ SO2 B 偏大 滴入锥形瓶中的液体排开的气体使量气装置中气体体积增大,导致计算的铝含量增多。
【解析】
Ⅰ.固体A隔绝空气加热,得到固体B,焰色反应为紫色,说明其含有K元素;与足量的BaCl2反应得到白色不溶于酸的沉淀,则固体C为BaSO4,固体B为K2SO4;混合气体D,冷却后得到固体E,E能与BaCl2溶液得到BaSO4沉淀,则E为SO3;由此可知,这三种元素为K、S、O,则另一种气体单质为O2。
Ⅱ.铁铝合金中,Al会与NaOH反应生成H2,通过生成氢气的量求出Al的质量,从而求出铝的含量。
Ⅰ.根据分析,固体A含有元素分别为K、S、O;固体B为K2SO4,固体B与BaCl2溶液反应后得到BaSO44.66g,其物质的量![]() ,根据关系式n(K)~2n(SO42-),则5.40gA中K的质量
,根据关系式n(K)~2n(SO42-),则5.40gA中K的质量![]() ;固体A中的S元素均转化为BaSO4中的硫元素,一共得到BaSO4的质量为4.66g+4.66g=9.32g;则5.40gA中S的质量
;固体A中的S元素均转化为BaSO4中的硫元素,一共得到BaSO4的质量为4.66g+4.66g=9.32g;则5.40gA中S的质量![]() ;根据质量守恒,5.40gA中O的质量
;根据质量守恒,5.40gA中O的质量![]() ;则物质A中各元素原子的比例
;则物质A中各元素原子的比例![]() ,A的最简式为KSO4,式量在200--300之间,则A的分子式为K2S2O8;
,A的最简式为KSO4,式量在200--300之间,则A的分子式为K2S2O8;
(1)C的化学式为BaSO4;组成A的三种元素为K、S、O;
(2)根据流程图,A物质分解得到K2SO4、SO3、O2。5.4gA的物质的量![]() ,根据得到固体C的质量可知,得到SO3和K2SO4的物质的量均为0.02mol,根据O2的体积可知,分解得到O2的物质的量为0.01mol,在化学方程式中,各物质的物质的量之比等于计量数之比,则可得化学方程式为2K2S2O8
,根据得到固体C的质量可知,得到SO3和K2SO4的物质的量均为0.02mol,根据O2的体积可知,分解得到O2的物质的量为0.01mol,在化学方程式中,各物质的物质的量之比等于计量数之比,则可得化学方程式为2K2S2O8 2K2SO4+2SO3↑+O2↑;
2K2SO4+2SO3↑+O2↑;
(3)SO3和SCl2反应得到SOCl2,SOCl2中S的化合价为+4。SCl2中S的化合价为+2,SO3中S的化合价为+6,在+2和+6之间只有+4,根据化合价只能靠近不能交叉的原则,则该反应另一种产物中S的化合价也为+4,是SO2,化学方程式为SO3+SCl2=SOCl2+SO2;
II.(1)A.该实验是通过测量气体的体积,来测定合金中Al的含量,因此气密性必须良好,A错误;
B.气体体积和压强有关,为了正确测量气体的体积,内外压强需相等,因此左右两边的液面差相等,B正确;
C.由于反应前装置中就有空气,生成的氢气会把空气排出,因此不必把生成的氢气转移至B中,C错误;
D.若生成的氢气过多,超过了量气装置的量程,则无法测得生成氢气的体积,但是要保证合金中的Al完全反应才能计算出Al的含量,NaOH必须足量,因此需要控制合金的用量,以防止生成的气体过多,D错误;
答案选B;
(2)若改为普通分液漏斗,则放入锥形瓶中的NaOH溶液的体积也会被算作生成氢气的体积,从而使计算出的Al质量偏大,铁铝合金中铝含量偏大。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表,下列说法正确的是
4NO2(g)+O2(g) ΔH >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表,下列说法正确的是
时间/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/mol·L-1 | 5.00 | 3.50 | 2.50 | 2.50 |
A. 500 s内NO2的生成速率为3.00×10-3 mol·L-1·s-1
B. T1温度下该反应平衡时N2O5的转化率为50%
C. 达平衡后其他条件不变,将容器体积压缩到原来的![]() ,c(N2O5)<5.00 mol·L-1
,c(N2O5)<5.00 mol·L-1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2