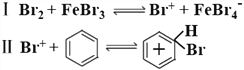
题目内容
【题目】X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素最高价氧化物对应水化物化学式分别为H2XO4和HYO4。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是 ( )。
A. 原子半径X>Y B. 氢化物稳定性H2X>HY
C. 原子核内质子数R<M D. 溶液碱性R(OH)2<M(OH)2
【答案】A
【解析】X、Y同周期,两种元素最高价氧化物对应水化物分别为H2![]() O4和H
O4和H![]() O4,所以X在Y元素的左边,原子半径:X>Y,非金属性:Y>X,氢化物稳定性HY>H2X,B错误;R与冷水即可反应,M与热水反应缓慢,说明R、M的金属性为M<R,R排在M的下面,原子核内质子数M<R,溶液碱性M(OH)2<R(OH)2。
O4,所以X在Y元素的左边,原子半径:X>Y,非金属性:Y>X,氢化物稳定性HY>H2X,B错误;R与冷水即可反应,M与热水反应缓慢,说明R、M的金属性为M<R,R排在M的下面,原子核内质子数M<R,溶液碱性M(OH)2<R(OH)2。

 ABC考王全优卷系列答案
ABC考王全优卷系列答案【题目】煤的气化主要反应是煤中碳与水蒸气反应生成CO、H2等。回答下列问题:
(1)CO与H2分别与O2都可以设计成燃料电池。CO与O2设计成燃料电池(以熔融碳酸盐为电解质)负极的电极反应为:______________;
(2)在煤的气化获得的化工原料气中含有少量羰基硫(COS),能引起催化剂中毒、大气污染等。COS的电子式为___________;羰基硫与烧碱溶液反应生成水喝两种正盐的离子方程式为:__________;羰基硫的脱硫常用两种方法,其反应式分别为:
①氢解反应:COS(g) + H2(g) = H2S(g) + CO(g) ΔH1=+7kJ/mol
②水解反应:COS(g) + H2O(g) = H2S(g) + CO2(g) ΔH2
已知反应中相关的化学键键能数据如下:
化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
则ΔH2=____________kJ/mol。
(3)脱硫处理后的CO和H2在催化剂作用下合成甲醇:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2=-90.14kJ/mol。该反应能自发的理由是_______
CH3OH(g)+H2O(g) ΔH2=-90.14kJ/mol。该反应能自发的理由是_______
①一定温度下,在两个容积都为为VL的恒容莫比容器中,按如下方式加入反应物,一段时间后达到平衡:
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、3a molH2、 n molCH3OH(g)、n molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则n的取值范围为_____________;
②甲容器保持恒容,欲增大H2的平衡转化率,可采取的措施有:________(答两点即可)