题目内容
【题目】发展新能源、改善空气质量等一直是化学研究的热点。回答下列问题:
(1)甲醇是可再生的清洁能源,可利用CO2与H2合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。该反应历程如图所示。

上述合成甲醇的反应的有机副产物有__________;由于该反应速率较慢,需要加入催化剂使反应速率加快,主要降低下列变化中________(填字母)的能量变化。
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(2)焦炭与水蒸气在恒容密闭容器中反应,可制合成气,主要反应(I)、(II)的lg KP(KP为以分压表示的平衡常数)与T的关系如图所示。

①反应(I)的△H______0(填“>”、“=”或“<”);
②在容积为10 L密闭容器中充入1 mol CO、1 mol H2O只发生反应(II),反应5分钟到达图中d点,请计算0~5 min时,CO平均反应速率________;此时CO的转化率为________;已知:反应速率v=v正-v逆=k正·x(CO)·x(H2O)-k逆·x(CO2)·x(H2),k正、k逆分别为正、逆反应速率常数,x为物质的量分数,计算e处的![]() =______;
=______;
③c点时,若反应容器中CO浓度为0.1 mol/L,则CO2浓度为________(填数值)。
【答案】CH2O A > 0.01 mol/(L·min) 50% 100 0.01 mol/L
【解析】
(1)由图可知,副产物有CO和CH2O,反应的能垒越低,反应越容易进行,副产物的量越多;反应的能垒越大,反应的反应速率越慢;
(2)①该反应正向是气体体积增大的反应,根据温度与化学平衡常数的对数关系分析温度与平衡移动的关系;
②根据图象确定Kp,利用物质加入量及转化量关系,确定平衡时各种物质的浓度,再根据化学反应速率和物质转化率的含义进行计算;根据e点lgKp计算CO转化率,得到各种气体的物质的量分数,结合该温度下的平衡常数,带入速率公式可得速率的比值;
③c点是两个反应的交点,二者的平衡常数相等,据此解答。
(1)由图可知生成副产物主要有CO和CH2O,其中的有机副产物是CH2O;由图可知生成甲醇的过程中,能垒最高(为1.64 eV)的变化为*CO+*OH→*CO+*H2O,该反应速率最慢,决定整个反应的快慢,所以要想提高整个反应速率,应该降低该反应的能垒,故合理选项是A;
(2)①根据图示可知:温度升高,lgKp增大,说明升高温度,平衡正向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,因此该反应的正反应为吸热反应,故△H>0;
②在容积为10 L密闭容器中充入1 mol CO、1 mol H2O只发生反应(II) CO(g)+H2O(g)![]() CO2(g)+H2(g),反应5分钟到达图中d点,此时lgKp=0,则Kp=1,根据化学反应速率与物质反应关系,由于加入1 mol CO、1 mol H2O,反应是按1:1物质的量关系进行,剩余的CO、H2O也是1:1物质的量关系,反应产生的CO2与H2的物质的量相等,则每种气体的物质的量及浓度都相同,此时n(CO)=0.5 mol,c(CO)=c(H2O)=c(H2)=c(CO2)=
CO2(g)+H2(g),反应5分钟到达图中d点,此时lgKp=0,则Kp=1,根据化学反应速率与物质反应关系,由于加入1 mol CO、1 mol H2O,反应是按1:1物质的量关系进行,剩余的CO、H2O也是1:1物质的量关系,反应产生的CO2与H2的物质的量相等,则每种气体的物质的量及浓度都相同,此时n(CO)=0.5 mol,c(CO)=c(H2O)=c(H2)=c(CO2)= ![]() =0.05 mol/L,则0~5 min时,CO平均反应速率v(CO)=
=0.05 mol/L,则0~5 min时,CO平均反应速率v(CO)= ![]() =0.01mol/(L·min);此时CO的转化率为
=0.01mol/(L·min);此时CO的转化率为![]() ×100%=50%;由于反应速率v=v正-v逆=k正·x(CO)·x(H2O)-k逆·x(CO2)·x(H2),反应达到平衡时,v正=v逆,所以k正·x(CO)·x(H2O)=k逆·x(CO2)·x(H2),则
×100%=50%;由于反应速率v=v正-v逆=k正·x(CO)·x(H2O)-k逆·x(CO2)·x(H2),反应达到平衡时,v正=v逆,所以k正·x(CO)·x(H2O)=k逆·x(CO2)·x(H2),则![]() =K,e点时lgKp=-2,Kp=10-2,由于反应开始时c(CO)=c(H2O)=0.1 mol/L,c(H2)=c(CO2)=0,假设反应产生CO2、H2的物质的量浓度是a mol/L,则平衡时c(CO)=c(H2O)=(1-a)mol/L,c(H2)=c(CO2)=a mol/L,该反应是反应前后气体体积不变的反应,则Kp=
=K,e点时lgKp=-2,Kp=10-2,由于反应开始时c(CO)=c(H2O)=0.1 mol/L,c(H2)=c(CO2)=0,假设反应产生CO2、H2的物质的量浓度是a mol/L,则平衡时c(CO)=c(H2O)=(1-a)mol/L,c(H2)=c(CO2)=a mol/L,该反应是反应前后气体体积不变的反应,则Kp=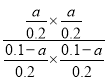 =10-2,解得a=0.1×
=10-2,解得a=0.1×![]() mol/L,c(CO)=c(H2O)=(1-a)mol/L=0.1×
mol/L,c(CO)=c(H2O)=(1-a)mol/L=0.1×![]() mol/L,所以x(CO)=x(H2O)=
mol/L,所以x(CO)=x(H2O)=![]() ,x(H2)=x(CO2)=
,x(H2)=x(CO2)=![]() ,根据图象可知,此温度下反应达到平衡时,Kp=1,所以e处的
,根据图象可知,此温度下反应达到平衡时,Kp=1,所以e处的![]() =Kp×
=Kp×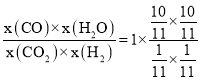 =100;
=100;
③对于反应(I)化学平衡常数K=![]() ;对于反应(II),化学平衡常数K=
;对于反应(II),化学平衡常数K=![]() ,由于c点是两个反应的交点,化学平衡常数相等,所以
,由于c点是两个反应的交点,化学平衡常数相等,所以![]() ,c(CO2)=c2(CO),由于此时反应容器中CO浓度为0.1 mol/L,所以c(CO2)=c2(CO)=(0.1)2 mol/L =0.01 mol/L。
,c(CO2)=c2(CO),由于此时反应容器中CO浓度为0.1 mol/L,所以c(CO2)=c2(CO)=(0.1)2 mol/L =0.01 mol/L。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】下列实验方案中,可以达到实验目的的是
选项 | 实验操作与现象 | 目的或结论 |
A | 用pH试纸分别测定相同温度和相同浓度的CH3COONa溶液和NaClO溶液的pH | 验证酸性:CH3COOH>HClO |
B | 在一定条件下,向混有少量乙烯的乙烷中通入氢气 | 除去乙烷中的乙烯 |
C | 向盛有少量Mg(OH)2固体的试管中加入适量NH4Cl浓溶液,充分振荡,白色固体溶解 |
|
D | 向NaI、NaCl混合稀溶液中滴加少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D