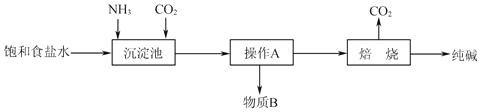
题目内容
【题目】目前手机屏幕主要由保护玻璃、触控层以及下面的液晶显示屏三部分组成。下面是工业上用丙烯(A)和有机物C(C7H6O3)为原料合成液晶显示器材料(F)的主要流程:
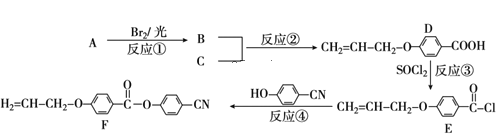
(1)化合物C的结构简式为___。B的官能团名称___。
(2)上述转化过程中属于取代反应的有___(填反应序号)。
(3)写出B与NaOH水溶液反应的化学方程式___。
(4)下列关于化合物D的说法正确的是___(填字母)。
A.属于酯类化合物 B.1molD最多能与4molH2发生加成反应
C.一定条件下发生加聚反应 D.核磁共振氢谱有5组峰
(5)写出符合下列条件下的化合物C的同分异构体的结构简式___(任写一种)。
①苯环上一溴代物只有2种 ②能发生银镜反应 ③苯环上有3个取代基
(6)请参照上述制备流程,写出以有机物C和乙烯为原料制备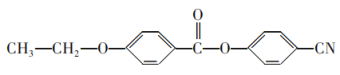 的合成路线流程图(无机试剂任用)___。
的合成路线流程图(无机试剂任用)___。
【答案】![]() 碳碳双键、溴原子 ①②③④ CH2=CH-CH2Br+NaOH
碳碳双键、溴原子 ①②③④ CH2=CH-CH2Br+NaOH![]()
![]() CH2=CH-CH2OH+NaBr bc
CH2=CH-CH2OH+NaBr bc 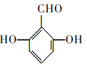 、
、 CH2=CH2
CH2=CH2![]() CH3CH2Cl
CH3CH2Cl![]()
![]()
【解析】
已知A为丙烯,与溴在光照的条件下发生取代反应生成溴丙烯,根据D的结构简式,可知B为3-溴丙烯,C为对羟基苯甲酸;
(1)根据分析可知,C中羟基与羧基在苯环的对位,结构简式为![]() ;B的结构简式为CH2=CH-CH2Br,含有的官能团有碳碳双键、溴原子;
;B的结构简式为CH2=CH-CH2Br,含有的官能团有碳碳双键、溴原子;
(2)A的结构简式为CH2=CH-CH3,B的结构简式为CH2=CH-CH2Br,则反应①为取代反应;C的结构简式为![]() ,D的结构简式为
,D的结构简式为![]() ,则反应②为取代反应;E的结构简式为
,则反应②为取代反应;E的结构简式为![]() ,则反应③为取代反应;F的结构简式为
,则反应③为取代反应;F的结构简式为![]() ,则反应④为取代反应;
,则反应④为取代反应;
(3)B的结构简式为CH2=CH-CH2Br,为溴代烃,在碱性条件下生成醇和溴化钠,反应的化学方程式为CH2=CH-CH2Br+NaOH![]() CH2=CH-CH2OH+NaBr;
CH2=CH-CH2OH+NaBr;
(4)化合物D的结构简式为![]() ,含有的官能团有碳碳双键、羧基、醚基,
,含有的官能团有碳碳双键、羧基、醚基,
A.化合物D中不含有酯基,不属于酯类化合物,与题意不符,A错误;
B.1molD中碳碳双键可与1mol氢气发生加成反应,苯环可与3mol氢气发生加成反应,最多能与4molH2发生加成反应,符合题意,B正确;
C.化合物D中含有碳碳双键,一定条件下发生加聚反应,符合题意,C正确;
D.核磁共振氢谱有6组峰,与题意不符,D错误;
答案为BC;
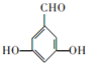
(5)化合物C为![]() ,其分子式为C7H6O3,其同分异构体符合②能发生银镜反应,③苯环上有3个取代基,分别为2个-OH、1个-CHO,①苯环上一溴代物只有2种,则该有机物为对称结构,可能结构为
,其分子式为C7H6O3,其同分异构体符合②能发生银镜反应,③苯环上有3个取代基,分别为2个-OH、1个-CHO,①苯环上一溴代物只有2种,则该有机物为对称结构,可能结构为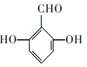 、
、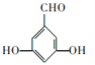 ;
;
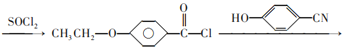
(6)有机物C为![]() ,根据制取产物,乙醇与
,根据制取产物,乙醇与![]() 发生取代反应生成
发生取代反应生成![]() ,再与SOCl2发生取代反应生成
,再与SOCl2发生取代反应生成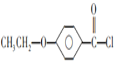 ,再与
,再与![]() 发生取代反应生成
发生取代反应生成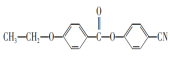 ,流程为CH2=CH2
,流程为CH2=CH2![]() CH3CH2Cl
CH3CH2Cl![]()
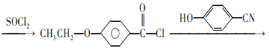
![]() 。
。

 阅读快车系列答案
阅读快车系列答案