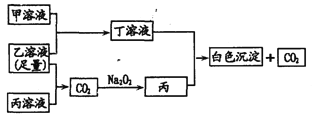
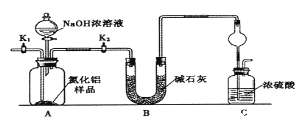
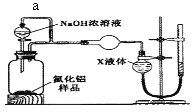
题目内容
【题目】用H2O2和H2SO4的混合溶液可溶出印刷电路板中的铜,其热化学方程式为Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l) ΔH已知①Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1=+64 kJ·mol-1②2H2O2(l)===2H2O(l)+O2(g) ΔH2=-196 kJ·mol-1③H2(g)+1/2O2(g)===H2O(l) ΔH3=-286kJ·mol-1。下列说法不正确的是
A. 反应①可通过铜作电极电解稀H2SO4的方法实现
B. 反应②在任何条件下都能自发进行
C. 若H2(g)+1/2O2(g)===H2O(g) ΔH4,则ΔH4<ΔH3
D. ΔH=-320 kJ·mol-1
【答案】C
【解析】
A.用铜作电极电解稀H2SO4时,两个电极的反应分别为:Cu-2e-=Cu2+、2H++2e-=H2↑,总反应为:Cu(s)+2H+(aq)![]() Cu2+(aq)+H2(g),故A说法正确;
Cu2+(aq)+H2(g),故A说法正确;
B.反应②的ΔH<0,ΔS>0,则在任何条件下均能自发进行,故B说法正确;
C.因为H2O(g)所具有能量较H2O(l)高,则反应H2(g)+![]() O2(g)===H2O(g)放出的热量较少,ΔH4>ΔH3,故C说法错误;
O2(g)===H2O(g)放出的热量较少,ΔH4>ΔH3,故C说法错误;
D.由盖斯定律可得ΔH=ΔH1+![]() ΔH2+ΔH3=-320 kJ·mol-1,故D说法正确;
ΔH2+ΔH3=-320 kJ·mol-1,故D说法正确;
答案选C。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。

(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为_____________________________________。
(2)上述生产流程中溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为______________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。