题目内容
17.已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间发生反应的现象如下:①A+B→白色沉淀,加入稀硝酸,沉淀不溶解;
②B+D→白色沉淀,在空气中放置,沉淀由白色变为灰绿色最后变为红褐色;
③C+D→白色沉淀,继续滴加D溶液,白色沉淀消失.则:
(1)写出下列反应的相应方程式:
上述反应②中生成白色沉淀后,在空气中放置,沉淀由白色变为红褐色的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
上述反应③中生成白色沉淀后,继续滴加D溶液,白色沉淀逐渐消失的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(2)若先向FeSO4溶液中滴加几滴新制的氯水,再向其中滴加几滴KSCN溶液,看到的现象是:溶液由浅绿色到浅黄色,再出现红色.
此过程所发生反应的离子方程式是:2Fe2++Cl2=2Fe3++2Cl-、Fe3++SCN-=[Fe(SCN)]2+.
分析 A+B→白色沉淀,加入稀硝酸,沉淀不溶解应生成BaSO4沉淀,B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色,应是Fe(OH)2的转化,说明A为BaCl2,B为FeSO4,C为AlCl3,D为NaOH,C与D生成白色沉淀为Al(OH)3,Al(OH)3溶于NaOH,据此解答.
解答 解:A+B→白色沉淀,加入稀硝酸,沉淀不溶解应生成BaSO4沉淀,B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色,应是Fe(OH)2的转化,说明A为BaCl2,B为FeSO4,C为AlCl3,D为NaOH,C与D生成白色沉淀为Al(OH)3,Al(OH)3溶于NaOH.
(1)反应②是FeSO4和NaOH反应生成Fe(OH)2,Fe(OH)2不稳定,可与空气中的氧气反应生成红褐色的Fe(OH)3,沉淀由白色变为红褐色的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
反应③是AlCl3与NaaOH生成白色沉淀为Al(OH)3,Al(OH)3溶于NaOH,白色沉淀逐渐消失的离子方程式:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;Al(OH)3+OH-=AlO2-+2H2O;
(2)若先向FeSO4溶液中滴加几滴新制的氯水,氯气将亚铁离子氧化为铁离子,再向其中滴加几滴KSCN溶液,看到的现象是:溶液由浅绿色到浅黄色,再出现红色,此过程所发生反应的离子方程式是:2Fe2++Cl2=2Fe3++2Cl-、Fe3++SCN-=[Fe(SCN)]2+,
故答案为:溶液由浅绿色到浅黄色,再出现红色;2Fe2++Cl2=2Fe3++2Cl-、Fe3++SCN-=[Fe(SCN)]2+.
点评 本题考查无机物的推断,难度不大,注意根据物质的性质以及反应的现象判断可能发生的反应.

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案| A. | 9 | B. | 20 | C. | 29 | D. | 38 |
| A. | 在FeSO4溶液中滴入KSCN溶液,溶液显红色 | |
| B. | 铁位于元素周期表中第4周期第Ⅷ族 | |
| C. | 在化合物中,铁通常呈现为+2,+3价 | |
| D. | 通常情况下,铁丝在氯气里燃烧时生成FeCl3 |
| A. | 甲烷高温分解 | B. | 甲烷能发生加聚反应 | ||
| C. | 甲烷是一种很好的燃料 | D. | 甲烷分子呈正四面体构型 |
| A. | 升高温度 | B. | 增大压强 | C. | 使用催化剂 | D. | 定时分离出氨 |
| A. | 溶液中c(Na+)═10-3mol/L | B. | 溶液中 c(R2-)>c(Na+)>c(H+)>c(OH-) | ||
| C. | 溶液中 c(R2-)+c(OH-)+c(HR-)═c(Na+)+c(H+) | D. | 溶液中 2c(R2-)+c(HR-)═c(Na+) |
| A. | 溶液的体积:10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)=═c(OH-)乙 | |
| C. | 若分别与5mLpH=11的NaOH溶液反应,所得溶液可能显酸性 | |
| D. | 若分别用等浓度的NaOH溶液完全中和,消耗NaOH溶液的体积不相同 |
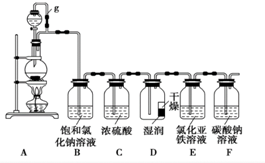 某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题:
某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题: