题目内容
8.将70g过氧化钠和氧化钠的混合物跟98g水充分反应后,所得氢氧化钠溶液溶质的质景分数为0.5%.试分别写出过氧化钠和氧化钠跟水反应的化学方程式,并计算原混合物中过氧化钠和氧化钠的质量各为多少克?分析 发生反应:2Na2O2+2H2O═4NaOH+O2↑、Na2O+H2O═2NaOH,设混合物中Na2O2和Na2O的物质的量分别为xmol、ymol,根据方程式表示出生成NaOH、氧气物质的量,溶液质量=70g+98g-氧气质量,再根据总质量、溶液质量分数列方程计算解答.
解答 解:设混合物中Na2O2和Na2O的物质的量分别为xmol、ymol,则:
2Na2O2+2H2O═4NaOH+O2↑
2 4 1
xmol 2xmol 0.5xmol
Na2O+H2O═2NaOH
1 2
ymol 2ymol
$\left\{\begin{array}{l}{78x+62y=70}\\{(2x+2y)×40=(70+98-2×0.5x)×50%}\end{array}\right.$
解得:x=y=0.5
m(Na2O2)=0.5 mol×78 g/mol=39 g,m(Na2O)=0.5 mol×62 g/mol=31g,
故答案为:混合物中Na2O2质量为39g,Na2O的质量为31g.
点评 本题考查混合物计算,明确发生的反应即可解答,关键是溶液质量计算,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列各选项中不属于官能团的是( )
| A. | OH- | B. | -NO2 | C. | -COOH | D. | -Cl |
16.下列说法不正确的是( )
| A. | 把碳棒放在酒精喷灯上灼烧 2-3min 后即投入到冷水中,重复操作几次,可制得多孔碳棒 | |
| B. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录 溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| C. | K2CrO4 溶液中存在平衡 2CrO${\;}_{4}^{2-}$+2H+Cr2O${\;}_{7}^{2-}$+H2O,加稀硝酸则溶液由黄色变为橙色 | |
| D. | 分光光度计可以用来测定某些化学反应的反应速率 |
3.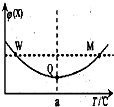 在某恒容密闭容器中充入一定量 X(g)和 Y(g),发生反应2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中 X 的体积分数与温度的 关系如图.下列推断正确的是( )
在某恒容密闭容器中充入一定量 X(g)和 Y(g),发生反应2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中 X 的体积分数与温度的 关系如图.下列推断正确的是( )
 在某恒容密闭容器中充入一定量 X(g)和 Y(g),发生反应2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中 X 的体积分数与温度的 关系如图.下列推断正确的是( )
在某恒容密闭容器中充入一定量 X(g)和 Y(g),发生反应2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中 X 的体积分数与温度的 关系如图.下列推断正确的是( )| A. | M 点时,Y 的转化率最大 | |
| B. | 升高温度,平衡常数减小 | |
| C. | 平衡后充入 Z 达到新平衡时 Z 的体积分数增大 | |
| D. | W,M 两点 Y 的正反应速率相等 |
13.下列离子方程式书写正确的是( )
| A. | 硫酸溶液与氧氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 向水中通入氯气:Cl2+H2O?2H++Cl-+ClO- | |
| C. | Na与H2O反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | H${\;}_{2}^{18}$O中投入Na2O2固体:2H${\;}_{2}^{18}$O+2Na2O2═4OH-+4Na++18O2↑ |
18.下列各冶炼方法中,不能制得相应金属的是( )
| A. | 把铁放入硫酸铜溶液中 | B. | 加热氧化铝 | ||
| C. | 铝粉与氧化铁高温共热 | D. | 电解熔融氯化钠 |
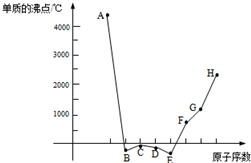 A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如图所示.
A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如图所示.