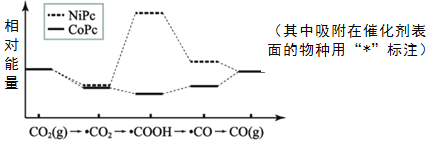
题目内容
【题目】短周期元素a、b、c、d的原子序数依次增大。其中A为d元素组成的非金属单质;甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物,常温下乙为液体。下列说法正确的是( )

A.简单离子半径:c>b
B.反应①为吸热反应
C.②反应中氧化剂与还原剂物质的量之比为1:1
D.b、d分别与a形成的化合物中,化学键类型一定完全相同
【答案】C
【解析】
由A为d元素组成的非金属单质,常温下乙为液体可知,乙为水、甲为氧化钠,水与氧化钠反应生成氢氧化钠,A为氯气,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,则a为H元素、b为O元素、c为Na元素、d为Cl元素。
A.O2—离子和Na+离子电子层结构相同,电子层结构相同的离子,随核电荷数增大,离子半径依次减小,则简单离子半径:O2—> Na+,故A错误;
B. 反应①为为水与氧化钠反应生成氢氧化钠,该化合反应为放热反应,故B错误;
C.反应②为氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,氯气即是氧化剂又是还原剂,物质的量之比为1:1,故C正确;
D.过氧化氢中含有极性键和非极性键,氯化氢中只含有极性键,化学键类型不完全相同,故D错误;
故选C。

【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如图:

已知:Ⅰ.铍、铝元素的化学性质相似,单质铍与氢氧化钠溶液反应生成可溶于水的Na2BeO2
Ⅱ.常温下部分难溶物的溶度积常数如下表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的主要成分除NaOH外,还有__(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:__。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为__(填字母)。
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
②从BeCl2溶液中得到BeCl2固体的操作是__。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:__。
②若用浓HNO3溶解金属硫化物,缺点是__(任写一条)。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是__(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于__。
(5)电解NaCl-BeCl2混合熔盐可制备金属铍,如图是电解装置图。

①石墨电极上的电极反应式为__。
②电解得到的Be蒸气中约含1%的Na蒸气除去Be中少量Na的方法为__。
已知部分物质的熔、沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |