题目内容
【题目】下图是一个化学过程的示意图。
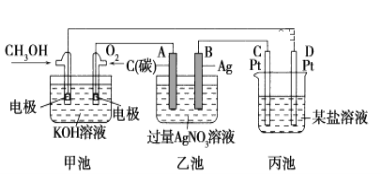
(1)图中甲池是________装置(填“电解池”或“原电池”)
(2)写出通入CH3OH的电极的电极反应式: _______________________。
(3)向乙池两电极附近分别滴加适量紫色石蕊试液,附近变红的电极为________极(填“A”或“B”),并写出此电极的电极反应式:______________。
(4)若丙中电极不变,将其溶液换成NaCl溶液,丙池中总反应的离子方程式:__________。
(5)常温下,当乙池中B(Ag)极的质量增加5.40 g时,乙池的pH是________(若此时乙池中溶液的体积为500 mL);
【答案】原电池 CH3OH-6e-+8OH-===CO32-+6H2O A 4OH--4e-=O2↑+2H2O 2Cl-+2H2O![]() Cl2+H2↑+2OH- 1
Cl2+H2↑+2OH- 1
【解析】
根据甲池能自发进行氧化还原反应,结合燃料电池的工作原理;通入甲醇的电极为负极、通入氧气的电极为正极,电解池中连接原电池负极的电极为阴极、连接原电池正极的电极为阳极;乙池有外接电源是电解池,阳极上氢氧根离子失电子生成氧气和水,阴极上银离子得电子,酸性溶液使紫色石蕊试液变红;根据银和氢离子关系式计算氢离子浓度,从而确定溶液的pH。
(1)图中甲池能自发进行氧化还原反应,将化学能转化为电能,所以属于原电池,故答案为原电池。
(2)甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;故答案为CH3OH-6e-+8OH-=CO32-+6H2O。
(3)乙池有外接电源属于电解池,连接原电池正极的A是阳极,连接原电池负极的B是阴极,电解硝酸银溶液时,A电极上氢氧根离子失电子生成氧气和水,溶液呈酸性,加入紫色石蕊试液呈红色,电极反应式为:4OH--4e-=O2↑+2H2O;故答案为A ;4OH--4e-=O2↑+2H2O。(4)用Pt电极电解氯化钠溶液时,氢离子得电子生成氢气、氯离子失电子生成氯气,总反应的离子方程式为:2Cl-+2H2O![]() Cl2+H2↑+2OH-,故答案为2Cl-+2H2O
Cl2+H2↑+2OH-,故答案为2Cl-+2H2O![]() Cl2+H2↑+2OH-。
Cl2+H2↑+2OH-。
(5)乙池中的总反应为:4Ag++2H2O![]() 4Ag+O2↑+4H+,当乙池中B(Ag)极的质量增加5.40g时,设氢离子浓度为xmol/L,则
4Ag+O2↑+4H+,当乙池中B(Ag)极的质量增加5.40g时,设氢离子浓度为xmol/L,则
4Ag++2H2O![]() 4Ag↓+O2↑+4H+
4Ag↓+O2↑+4H+
432g 4mol
5.40g 0.5xmol
![]()
解得x=0.1mol/L,则溶液的pH=1,故答案为1。

【题目】CO2的回收与利用是科学家研究的热点课题。可利用CH4与CO2制备合成气(CO、H2),还可制备甲醇、二甲醚、低碳烯经等燃料产品。
I.科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)C(ads) +2H2(g) (慢反应)
反应②:C(ads) + CO2(g)2CO(g) (快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
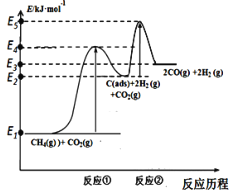
(1)CH4与CO2制备合成气的热化学方程式为____________:该反应在高温下可自发正向进行的原因是_________,能量变化图中:E5+E1___E4+E2(填“>”、“<”或“=”)。
II.利用“合成气”合成申醇后,脱水制得二甲醚。
反应为:2CH3OH(g)CH3OCH3 (g) + H2O(g) △H
经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度存在如下关系:lnKc=-2.205+![]() 。其速率方程为:v正=k正c2(CH3OH),v逆=k逆c(CH3OCH3)c(H2O),k正、K逆为速率常数,且影响外因只有温度。
。其速率方程为:v正=k正c2(CH3OH),v逆=k逆c(CH3OCH3)c(H2O),k正、K逆为速率常数,且影响外因只有温度。
(2)反应达到平衡后,仅升高温度,k正增大的倍数________ k逆增大的倍数(填“>”、“<”或“= ”)。
(3)某温度下,Kc=200,在密闭容器中加入一定量CH3OH。反应到某时刻测得各组分的物质的量如下:
物质 | CH3OH | CH3OCH3 | H2O |
物质的量/mol | 0.4 | 0.4 | 0.4 |
此时正、逆反应速率的大小:v正 ____v逆(填“>”、“<”或“=”)。
(4)500K下,在密闭容器中加入一定量甲醇CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为_____(埴标号)
A.![]() B.
B.![]() C.
C.![]() D.无法确定
D.无法确定
Ⅲ.合成低碳烯经
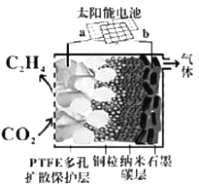
(5)强碱性电催化还原CO2制备乙烯研究取得突破进展,原理如图所示。b极接的是太阳能电池的_______极(已知PTFE浸泡了饱和KCl溶液)。请写出阴极的电极反应式______。