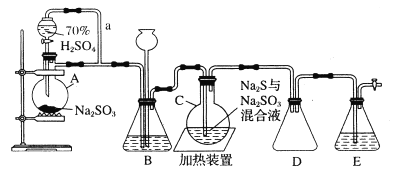
题目内容
【题目】高锰酸钾在饮用水和工业污水处理领域的消费增长较快。实验室可用软锰矿(主要成分为MnO2)为原料制备高锰酸钾。其部分流程如下:
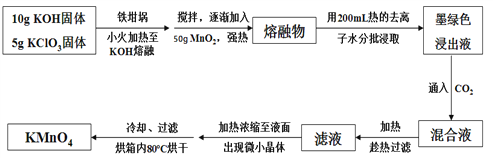
已知:墨绿色浸出液的成分为K2MnO4、KCl溶液
回答下列问题:
(1)实验中采用铁坩埚而不是瓷坩埚的原因是:(用化学反应方程式表示)___________________________________________________。
(2)写出生成K2MnO4和KCl反应的化学方程式:________________________;通入CO2,可使MnO42-发生反应,生成MnO![]() 及MnO2。若通入CO2太多,则在加热浓缩时,会有__________________晶体和KMnO4晶体一起析出。
及MnO2。若通入CO2太多,则在加热浓缩时,会有__________________晶体和KMnO4晶体一起析出。
(3)在加热、浓缩、烘干的过程中温度不宜过高,其原因是(用化学反应方程式表示)_________________________;过滤用到的玻璃仪器有烧杯、_________、_______;加热时用玻璃棒不断搅拌溶液的目的是_______________________________________;洗涤KMnO4晶体用冷水洗涤较好的原因是_______________________________________。
(4)计算12.25 g KClO3固体经过上述转化,最多可制得KMnO4的质量为___________(结果保留一位小数)。(相对原子质量:K—39 Cl—35.5 O—16 Mn—55)
【答案】 SiO2+2KOH ![]() K2SiO3+H2O KClO3+3MnO2+6KOH
K2SiO3+H2O KClO3+3MnO2+6KOH ![]() 3K2MnO4+KCl+3H2O KHCO3 2KMnO4
3K2MnO4+KCl+3H2O KHCO3 2KMnO4 ![]() O2↑+MnO2+K2MnO4 漏斗 玻璃棒 受热均匀利于蒸发溶剂 减少高锰酸钾的溶解 31.6 g
O2↑+MnO2+K2MnO4 漏斗 玻璃棒 受热均匀利于蒸发溶剂 减少高锰酸钾的溶解 31.6 g
【解析】(1)坩埚原料含有SiO2,在高温下,瓷坩埚可以和KOH发生反应SiO2+2KOH![]() K2SiO3+H2O,腐蚀瓷坩埚,故不能使用瓷坩埚,而使用铁坩埚,故答案为:SiO2+2KOH
K2SiO3+H2O,腐蚀瓷坩埚,故不能使用瓷坩埚,而使用铁坩埚,故答案为:SiO2+2KOH![]() K2SiO3+H2O;
K2SiO3+H2O;
(2)由题意可知,KOH、KClO3、MnO2共熔制得绿色溶液中含有K2MnO4,KCl,由元素守恒可知,还会生成H2O,反应方程式为:KClO3+3MnO2+6KOH![]() KCl+3K2MnO4+3H2O,
KCl+3K2MnO4+3H2O,
由工艺流程可知,通入CO2,可以使MnO42-发生歧化反应生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,若通入CO2太多会生成KHCO3,会有KHCO3晶体和KMnO4晶体一起析出,故答案为:KClO3+3MnO2+6KOH![]() KCl+3K2MnO4+3H2O;KHCO3;
KCl+3K2MnO4+3H2O;KHCO3;
(3)温度过高KMnO4发生分解反应:2KMnO4![]() O2↑+MnO2+K2MnO4,故在加热、浓缩、烘干的过程中温度不宜过高;过滤用到的玻璃仪器有烧杯、玻璃棒、漏斗;加热时用玻璃棒不断搅拌,受热均匀利于蒸发溶剂,防止液体飞溅;洗涤KMnO4晶体用冷水洗涤,降低溶解度,减少因溶解导致的损失,故答案为:2KMnO4
O2↑+MnO2+K2MnO4,故在加热、浓缩、烘干的过程中温度不宜过高;过滤用到的玻璃仪器有烧杯、玻璃棒、漏斗;加热时用玻璃棒不断搅拌,受热均匀利于蒸发溶剂,防止液体飞溅;洗涤KMnO4晶体用冷水洗涤,降低溶解度,减少因溶解导致的损失,故答案为:2KMnO4![]() O2↑+MnO2+K2MnO4;玻璃棒、漏斗;受热均匀利于蒸发溶剂;减少高锰酸钾的溶解;
O2↑+MnO2+K2MnO4;玻璃棒、漏斗;受热均匀利于蒸发溶剂;减少高锰酸钾的溶解;
(4)生成K2MnO4的反应为:KClO3+3MnO2+6KOH ![]() KCl+3K2MnO4+3H2O,通入二氧化碳时,MnO42-→MnO4-,MnO42-→MnO2,根据电子转移守恒2n(MnO2)=n(MnO4-),根据锰元素守恒可知,转化KMnO4的MnO42-占
KCl+3K2MnO4+3H2O,通入二氧化碳时,MnO42-→MnO4-,MnO42-→MnO2,根据电子转移守恒2n(MnO2)=n(MnO4-),根据锰元素守恒可知,转化KMnO4的MnO42-占![]() ,可得关系式:KClO3~3K2MnO4~2KMnO4,设12.25g KClO3固体经过上述转化,最多可制得KMnO4的质量为x,则:
,可得关系式:KClO3~3K2MnO4~2KMnO4,设12.25g KClO3固体经过上述转化,最多可制得KMnO4的质量为x,则:
KClO3~3K2MnO4~2KMnO4
122.5 316
12.25g x
所以x=![]() =31.6g故答案为:31.6。
=31.6g故答案为:31.6。

 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案【题目】氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
(1)实验室可用下图所示装置合成氨。
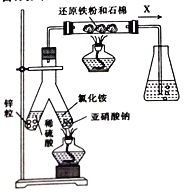
①亚硝酸钠与氯化铵反应的离子方程式为_____________________。
②锥形瓶中盛有一定量水并滴有几滴酚酞试剂。反应一段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、_____和____(填化学式)
(2)最近斯坦福大学研究人员 发明 了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。
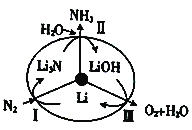
①图中反应Ⅱ属于________(填“氧化还原反应”或“非氧化还原反应”)。
②反应Ⅲ中能量转化的方式是________(填“电能转变为化学能”或“化学能转变为电能”)。
(3)液氨可用作制冷剂,液氨气化时________(填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示:
共价键 | N-H | O=O | N≡N | O-H |
键能/kJ.mol-1 | 391 | 498 | 946 | 463 |
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热△H=__________。