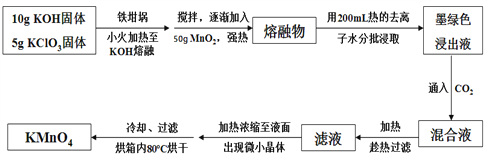
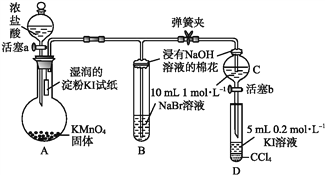
题目内容
【题目】下图是实验室制取Na2S2O3·5H2O的装置图(略去部分夹持仪器)。
已知:Na2SO3 +S![]() Na2S2O3
Na2S2O3
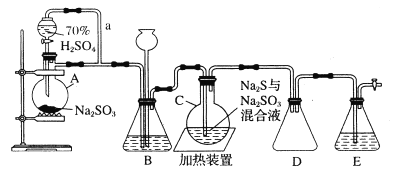
按要求回答下列问题:
(1)仪器A的名称是___________________。
(2)分液漏斗中用70%较浓硫酸的理由是___________________。
(3)装置C中生成S的离子反应方程式是___________________。
(4)E是SO2的尾气处理装置,则装置D的作用是___________________。
【答案】 蒸馏烧瓶 98%浓硫酸的水太少,硫酸电离的H+少,酸性弱,无法实现强酸制弱酸;而稀硫酸中水太多,二氧化硫易溶于水,不利于制备 2S2-+3SO2=3S↓+2SO32- 防倒吸
【解析】(1)根据仪器A的结构可知名称是蒸馏烧瓶。(2)由于98%浓硫酸的水太少,硫酸电离的H+少,无法实现强酸制弱酸;而稀硫酸中水太多,二氧化硫易溶于水,不利于制备,所以分液漏斗中用70%较浓硫酸。(3)二氧化硫具有氧化性,能和硫离子反应生成单质硫,则装置C中生成S的离子反应方程式是2S2-+3SO2=3S↓+2SO32-。(4)E是SO2的尾气处理装置,由于SO2易溶于水,所以装置D的作用是防倒吸。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目