题目内容
【题目】氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
(1)实验室可用下图所示装置合成氨。
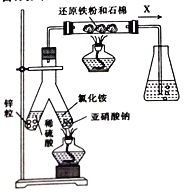
①亚硝酸钠与氯化铵反应的离子方程式为_____________________。
②锥形瓶中盛有一定量水并滴有几滴酚酞试剂。反应一段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、_____和____(填化学式)
(2)最近斯坦福大学研究人员 发明 了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。
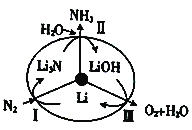
①图中反应Ⅱ属于________(填“氧化还原反应”或“非氧化还原反应”)。
②反应Ⅲ中能量转化的方式是________(填“电能转变为化学能”或“化学能转变为电能”)。
(3)液氨可用作制冷剂,液氨气化时________(填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示:
共价键 | N-H | O=O | N≡N | O-H |
键能/kJ.mol-1 | 391 | 498 | 946 | 463 |
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热△H=__________。
【答案】 NO2+NH4+![]() N2↑+2H2O H2 NH3 非氧化还原反应 电能转变为化学能 吸收 -1262 kJ.mol-1
N2↑+2H2O H2 NH3 非氧化还原反应 电能转变为化学能 吸收 -1262 kJ.mol-1
【解析】(1)①亚硝酸钠具有强氧化性与氯化铵发生氧化还原反应,生成氮气,反应的离子方程式为NO2+NH4+![]() N2↑+2H2O,故答案为:NO2+NH4+
N2↑+2H2O,故答案为:NO2+NH4+![]() N2↑+2H2O;
N2↑+2H2O;
②锌与稀硫酸反应生成的氢气与亚硝酸钠和氯化铵反应生成的氮气在催化剂作用下反应生成了氨气,因此锥形瓶中酚酞溶液变红,则气体X的成分为N2、水蒸气、H2、NH3,故答案为:H2、NH3;
(2)①反应Ⅱ是Li3N与水反应生成氨气的过程,反应中没有元素化合价的变化,属于非氧化还原反应,故答案为:非氧化还原反应;
②反应Ⅲ中氢氧化锂转变为锂、氧气和水,发生了氧化还原反应,属于非自发的氧化还原反应,属于电解池反应,能量转化的方式是电能转变为化学能,故答案为:电能转变为化学能;
(3)液氨可用作制冷剂,是因为液氨气化时吸收能量,导致周围温度降低;反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=反应物的键能之和-生成物的键能之和=391×3×4+498×3-946×2-463×2×6=-1262 kJ·mol-1,故答案为:吸收;-1262 kJ·mol-1。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案【题目】如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( ) 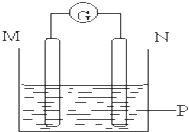
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A
B.B
C.C
D.D