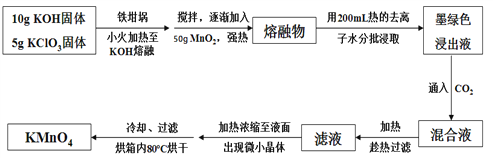
题目内容
【题目】锌是一种重要的金属,锌及其化合物有着广泛的应用.
(1)指出锌在周期表中的位置:第周期第族,属于区.
(2)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式;葡萄糖分子[CH2OHCHOH(CHOH)3CHO]中碳原子杂化方式有 .
(3)Zn2+能与NH3形成配离子[Zn(NH3)4]2+ . 配位体NH3分子中心原子的 杂化方式是 , 属于(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图中用箭头表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键 . 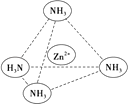
【答案】
(1)四;ⅡB;ds
(2)1s22s22p63s23p63d10或[Ar]3d10;sp2、sp3
(3)sp3;极性分子;
【解析】解:(1)Zn的原子序数是30,其电子排布式为:1s22s22p63s23p63d104s2 , 由电子排布式可知该元素为第四周期,第ⅡB族,Zn的外围电子排布式为3d104s2 , 属于ds区,所以答案是:四;ⅡB;ds;(2)Zn的原子序数是30,其电子排布式为:1s22s22p63s23p63d104s2 , Zn2+基态电子排布式为:1s22s22p63s23p63d10或[Ar]3d10 , 葡萄糖里有两种碳原子,葡萄糖是无羟基醛,所以,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(醛基里的碳),所以答案是:1s22s22p63s23p63d10或[Ar]3d10;sp2、sp3;(3)NH3分子中心N原子孤电子对数= ![]() =1,价层电子对数=3+1=4,故N原子采取sp3杂化,分子的立体构型为三角锥形,正负电荷重心不重合的分子为极性分子,从整个分子来看,NH3分子电荷的分布是不均匀的,不对称的,是极性分子,[Zn(NH3)4]2+中Zn2+与N之间的化学键是配位键,图示为:
=1,价层电子对数=3+1=4,故N原子采取sp3杂化,分子的立体构型为三角锥形,正负电荷重心不重合的分子为极性分子,从整个分子来看,NH3分子电荷的分布是不均匀的,不对称的,是极性分子,[Zn(NH3)4]2+中Zn2+与N之间的化学键是配位键,图示为:  ,
,
所以答案是:sp3;极性分子;  .
.