题目内容
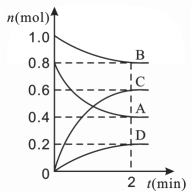
【题目】醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验研究”的探究活动。
(1)本课题的研究对象是CH3COOH,研究目的是_____,研究方法是实验研究。
(2)该同学设计了如下方案:
A.先配制一定量的0.10mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质。
B.先配制0.01mol/L和0.10mol/L的CH3COOH,分别测他们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质。
C.先测0.10mol/LCH3COOH的pH,然后将其加热至100℃(不考虑醋酸挥发),再测pH,如果pH变小,则可证明醋酸是弱电解质。
D.配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质。
你认为上述方案可行的是____(多项选择)
(3)请回答以下两个问题:
①弱电解质的特点是____(多项选择)
A.在水溶液中全部电离 B.在水溶液中部分电离
C.水溶液呈酸性 D.水溶液中存在电离平衡
②写出醋酸的电离方程式:____。
【答案】证明醋酸是弱电解质 A、B、C、D B、D CH3COOH![]() CH3COO-+H+
CH3COO-+H+
【解析】
(1)研究目的是证明醋酸是弱电解质;
(2)A.先配制一定量的0.10mol/LCH3COOH溶液,然后测溶液的pH,若pH大于1,醋酸不能完全电离,则可证明醋酸为弱电解质,方案可行;
B.用pH计分别测0.01mol/L和0.10mol/L的醋酸溶液的pH,若两者的pH相差小于1,说明醋酸存在电离平衡,则可证明醋酸是弱电解质,方案可行;
C.先测0.10mol/LCH3COOH的pH,然后将其加热至100℃,再测pH,如果pH变小,说明温度升高,促进电离,则可证明醋酸为弱电解质,方案可行;
D.配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸根离子发生水解,所以证明醋酸是弱酸,方案可行;
答案选ABCD;
(3)①弱电解质不完全电离,特点是在水溶液中存在电离平衡,故选BD;
②醋酸是弱电解质,部分电离,电离方程式为CH3COOHCH3COO-+H+。

 名校课堂系列答案
名校课堂系列答案【题目】卤块的主要成分是MgCl2,此外还含铁的氯化物、CuCl2、SiO2、MnO2等杂质。工业上以卤块为原料可制得轻质氧化镁,工艺流程如图所示:

已知:生成氢氧化物沉淀的pH如下表所示:
物质 | 开始沉淀 | 完全沉淀 |
Fe(OH)3 | 1.9 | 3.2 |
Fe(OH)2 | 7.6 | 9.6 |
Cu(OH)2 | 6.0 | 8.0 |
Mn(OH)2 | 7.3 | 9.3 |
Mg(OH)2 | 9.1 | 11.1 |
请回答下列问题
(1)滤渣1的成分有______________________(填化学式)。加入试剂1的目的是___________。
(2)步骤“加NaOH”需要调节pH值的范围为______________________。
(3)沉淀1的成分为______________________ (填化学式),步骤“加水煮沸”发生反应的化学方程式为______________________。
(4)步骤“加水煮沸”不能时间太长,原因是______________________。
(5)最近研究表明,常温下在含有Mg2+浓度为1.5mol/L的溶液中加入2倍于Mg2+的物质的量的NH4HCO3,控制pH值在9.5左右,镁的沉淀率能达到99%。产物为一种含结晶水的复盐,可用于煅烧制取轻质氧化镁,经XDR(X射线衍射)分析该复盐含水与含镁的物质的量相等。写出制取该复盐的离子方程式:_________________________________。
(6)除了OH-之外,S2-也是一种常见的金属离子沉淀剂。本质原因是一些金属硫化物的溶解度极小。已知:25℃时,CuS的溶度积为4×10-36,H2S的Ka1=1.25×10-7,Ka2=8.0×10-14。若要在1L.的盐酸中完全溶解0.01 mol CuS,理论上需要盐酸的最低浓度为___________mol/L(提示:用离子方程式计算)
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
【题目】I.无水MgBr2可用作催化剂,实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持装置省略)。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5。
MgBr2·3C2H5OC2H5。

主要步骤如下:
步骤1:三颈烧瓶中装入10g镁屑和150mL无水乙醚;装置C中加入15mL液溴;
步骤2:缓慢通入干燥的氩气,直至溴完全导入三颈烧瓶中;
步骤3:反应完毕后恢复至室温,过滤除去镁,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品;
步骤4:常温下用CCl4溶解粗品,冷却至0℃,析岀晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
请回答下列问题
(1)仪器A的名称是___________。B的作用为___________。
(2)下列有关步骤4的说法正确的是___________(填选项字母)
A.可用75%的乙醇代替CCl4溶解粗品
B.加热至160℃的主要目的是除去CCl4
C.洗涤晶体可选用0℃的CCl4
D.该步骤只除去了可能残留的溴
(3)若将装置C改为装置D,可能会导致的后果是___________。
(4)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,以铬黑T(简写为In)为指示剂。已知Mg2+与铬黑T和EDTA均能形成配合物,且EDTA与Mg2+配合更稳定:
物质 | 颜色 | 物质 | 颜色 |
Y4- | 无色 | MgY2- | 无色 |
In | 纯蓝色 | MgIn- | 酒红色 |
反应的离子方程式为Mg2++Y4-=MgY2-
①滴定终点的现象为______________________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,加入2滴铬黑T试液作指示剂,用0.0500mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00mL,则测得无水MgBr2产品的纯度是______________________(用质量分数表示)。
Ⅱ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4===27H2O+10MgO+3Al2O3。
(5)写出该化合物作阻燃剂的两条依据:______________________。
(6)MgO可溶于NH4Cl的水溶液,用离子方程式表示其原理:______________________。