题目内容
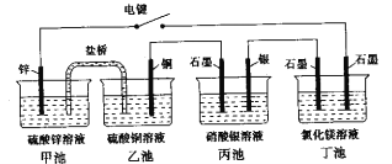
【题目】利用如图所示装置,甲中盛有100mL 0.1mol/LCuSO4溶液,乙中盛有100mL 0.2mol/L Na2SO4溶液。
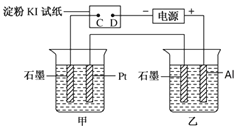
(1)通电一段时间,观察到湿润的淀粉KI试纸的_____(选填“C” 或“D”)端变蓝。
(2)装置乙中Al极的电极反应式为:_____________________。一段时间后观察到装置乙中的现象是:_________________。
(3)若电解一段时间后,装置甲中收集到气体0.056 L(标准状况下),则:装置甲中发生反应的离子反应方程式为______________________________。
(4)若电解一段时间后,装置甲中溶液需加入0.005molCu2(OH)2CO3才能恢复原来的浓度和pH,则电解过程中转移电子的物质的量为__________。
(5)某新型燃料电池,以甲醇为燃料,另一极通入一定量的CO2和O2的混合气体。一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,则负极反应式为______________。正极反应式为_________________。
【答案】 C Al-3e-= Al3+ 产生白色沉淀 2Cu2+ + 2H2O![]() 2Cu + O2↑+ 4H+ 0.03mol CH3OH- 6e- + 3CO32-=4CO2+2H2O O2+4e-+2CO2=2CO32-
2Cu + O2↑+ 4H+ 0.03mol CH3OH- 6e- + 3CO32-=4CO2+2H2O O2+4e-+2CO2=2CO32-
【解析】试题分析:(1)根据图示,湿润的淀粉KI试纸构成电解池,C是阳极、D是阴极;(2)装置乙构成电解池, Al极是阳极、石墨是阴极;(3)装置甲构成电解池,Pt是阳极、石墨是阴极;
解析:(1)根据图示,湿润的淀粉KI试纸构成电解池,C是阳极,电极反应是![]() ;D是阴极,阴极反应是
;D是阴极,阴极反应是![]() ,所以湿润的淀粉KI试纸的C端变蓝;(2)装置乙构成电解池, Al极是阳极、石墨是阴极,阳极反应是
,所以湿润的淀粉KI试纸的C端变蓝;(2)装置乙构成电解池, Al极是阳极、石墨是阴极,阳极反应是![]() 、阴极反应是
、阴极反应是![]() ,一段时间后生成氢氧化铝,观察到装置乙中产生白色沉淀;(3)装置甲构成电解池,Pt是阳极、石墨是阴极,阳极反应是
,一段时间后生成氢氧化铝,观察到装置乙中产生白色沉淀;(3)装置甲构成电解池,Pt是阳极、石墨是阴极,阳极反应是![]() ,装置甲中收集到气体0.056 L(标准状况下),气体全是氧气,此时转移电子0.01mol,阴极反应只有
,装置甲中收集到气体0.056 L(标准状况下),气体全是氧气,此时转移电子0.01mol,阴极反应只有![]() ,所以装置甲中发生反应的离子反应方程式为2Cu2+ + 2H2O
,所以装置甲中发生反应的离子反应方程式为2Cu2+ + 2H2O![]() 2Cu + O2↑+ 4H+;(4)若电解一段时间后,装置甲中溶液需加入0.005molCu2(OH)2CO3才能恢复原来的浓度和pH,说明阴极生成0.01mol铜和0.005mol氢气,所以电解过程中转移电子的物质的量为0.03mol;(5)正极是氧气得电子发生还原反应,正极反应式是O2+4e-+2CO2=2CO32-;负极是甲醇失电子发生氧化反应,负极反应式是CH3OH- 6e- + 3CO32-=4CO2+2H2O。
2Cu + O2↑+ 4H+;(4)若电解一段时间后,装置甲中溶液需加入0.005molCu2(OH)2CO3才能恢复原来的浓度和pH,说明阴极生成0.01mol铜和0.005mol氢气,所以电解过程中转移电子的物质的量为0.03mol;(5)正极是氧气得电子发生还原反应,正极反应式是O2+4e-+2CO2=2CO32-;负极是甲醇失电子发生氧化反应,负极反应式是CH3OH- 6e- + 3CO32-=4CO2+2H2O。

 阅读快车系列答案
阅读快车系列答案