题目内容
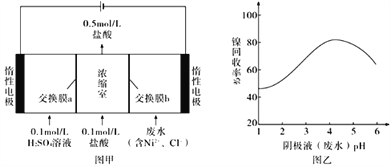
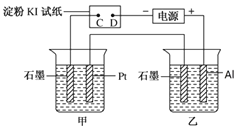
【题目】某化学学习小组学习电化学后。设计了下面的实验装置图(合上电键):
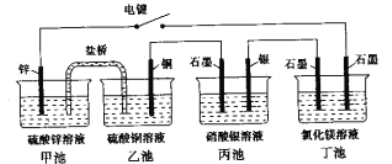
(1)电极名称,铜电极___(填写“正极”、“负极”、“阴极”、“阳极”,下同),银电极_____。
(2)丙池石墨电板上发生的电极反应式为_______,丁池中发生反应的离子方程式为_______。
(3)一段时间,当丙池中生成标准状况下560mL气体时,丁池中理论上最多产生______g固体。
【答案】 正极 阴极 ![]()
![]()
![]()
![]() 2.9
2.9
【解析】(1)合上电键后,相当于以甲池、乙池构成原电池,丙池为电镀池,丁池为电解池,活泼的金属锌变原电池的负极,则铜电极为正极;连接负极的银电极为阴极;(2)合上电键后,丙中银电极为电镀池的阴极析出银,石墨电极为阳极,电极上水电离出的氢氧根离子放电,电极反应为![]() ;丁池电解氯化镁溶液产生氢氧化镁、氢气和氯气,发生反应的离子方程式为
;丁池电解氯化镁溶液产生氢氧化镁、氢气和氯气,发生反应的离子方程式为![]()
![]()
![]() ;(3)丙中反应为2H2O+4AgNO3
;(3)丙中反应为2H2O+4AgNO3![]() 4Ag+O2↑+4HNO3,丁池中反应为MgCl2+2H2O
4Ag+O2↑+4HNO3,丁池中反应为MgCl2+2H2O![]() Cl2↑+H2↑+Mg(OH)2↓,根据电子守恒,
Cl2↑+H2↑+Mg(OH)2↓,根据电子守恒,
O2 ~4e-~2Mg(OH)2
![]() mol n
mol n
则n=0.05mol,所以氢氧化镁的质量为0.05mol×58g/mol=2.9g。

【题目】对下列实验现象解释正确的是
实验内容 | 实验现象 | 相关解释 | |
A | 等量的Cu分别与等体积足量的浓硝酸和稀硝酸反应 | 浓硝酸反应后呈绿色,稀硝酸反应后呈蓝色 | c(Cu2+)不同 |
B | NH3与Cl2混合 | 生成白烟 | NH3与Cl2发生化合反应生成NH4Cl |
C | 往Fe(OH)3胶体中逐滴滴入稀盐酸 | 先出现红褐色沉淀,后沉淀溶解 | 先胶体聚沉,后Fe(OH)3溶解 |
D | 加热硝酸铜固体,将带火星的木条伸入所得的气体中 | 生成红棕色气体,带火星木条复燃 | 2Cu(NO3)2 |
A. A B. B C. C D. D
【题目】用如下图装置实验,下列实验现象预期及相应结论均正确的是
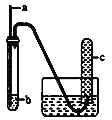
a | b | 实验现象预期 | 结论 | |
A | 铁丝 | HCl酸化的H2O2 | c中收集到无色气体 | 铁丝催化H2O2分解 |
B | 铜丝 | 浓硝酸 | c中收集到红棕色气体 | 硝酸有强氧化性 |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
D | 木条 | 浓硫酸 | 木条变黑 | 浓硫酸有强氧化性 |
A. A B. B C. C D. D