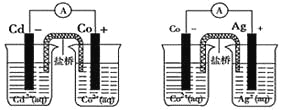
题目内容
【题目】对于1L H2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol/L,则理论上最多能溶解铜的物质的量为
A. 0.40mol B. 0.45mol C. 0.72mol D. 0.80mol
【答案】C
【解析】
铜与稀硫酸不反应,但和稀硝酸反应。离子方程式3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,硫酸电离出的氢离子可参与反应,由此进行计算。
铜不与硫酸反应,但能提供氢离子。硝酸与铜反应,生成硝酸铜,硝酸根离子与硫酸提供的氢离子可以继续反应,离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,硝酸根离子的浓度与氢离子的浓度比为1:4时,溶解的铜最多。
设硫酸的物质的量为x mol,硝酸的物质的量为y mol,则x+y=1.2,y:(2x+y)=1:4,解得x=0.72mol,y=0.48mol。故参加反应的铜的最大量n(Cu)=n(NO3-)×![]() =0.48mol×
=0.48mol×![]() =0.72mol。
=0.72mol。
本题选C。

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目