题目内容
同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:N2(g)+3 H2(g)
H2(g) 2NH3(g) △H= -92.6 kJ / mol。测得数据如下表:
2NH3(g) △H= -92.6 kJ / mol。测得数据如下表:
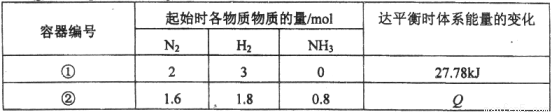
下列叙述不正确的是
A.容器②中反应开始时v(正)> v(逆)
B.容器①、②中反应达平衡时压强相等
C.容器②中反应达平衡时,吸收的热量Q为9.26 kJ
D.若条件为“绝热恒容”,容器①中反应达平衡时n (NH3)< 0.6 mol
练习册系列答案
 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
5.在2L的容器里有某反应物4mol,反应进行2秒后,该反应物还剩3.2mol,则该反应的平均速率为( )(mol•L-1•s-1)
| A. | 0.1 | B. | 0.2 | C. | 0.4 | D. | 0.8 |
7.CoCl2•6H2O是一种饲料营养强化剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种新工艺流程如图:
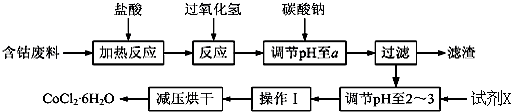
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为减少有毒气体的排放,防止大气污染;防止产品中混有硝酸盐(写两点).
(2)加入碳酸钠调节pH至a,a的范围是5.2~7.6;pH调至a后过滤,再用试剂X将滤液的pH调节至2-3,则所用的试剂X为盐酸.
(3)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(4)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定产品中CoCl2•6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2•6H2O的质量分数大于100%,其原因可能是样品中含有NaCl杂质,CoCl2•6H2O烘干时失去了部分结晶水(写出两个原因).
(6)在实验室中,为了从上述产品中获得纯净的CoCl2•6H2O,常将制得的产品溶解于乙醚中,然后过滤、蒸馏(填实验操作)获得纯净的CoCl2•6H2O.

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为减少有毒气体的排放,防止大气污染;防止产品中混有硝酸盐(写两点).
(2)加入碳酸钠调节pH至a,a的范围是5.2~7.6;pH调至a后过滤,再用试剂X将滤液的pH调节至2-3,则所用的试剂X为盐酸.
(3)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(4)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定产品中CoCl2•6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2•6H2O的质量分数大于100%,其原因可能是样品中含有NaCl杂质,CoCl2•6H2O烘干时失去了部分结晶水(写出两个原因).
(6)在实验室中,为了从上述产品中获得纯净的CoCl2•6H2O,常将制得的产品溶解于乙醚中,然后过滤、蒸馏(填实验操作)获得纯净的CoCl2•6H2O.


 C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是 J?mol—1
J?mol—1 的一个课题,污染分为空气污染,水污染,土壤污染等。
的一个课题,污染分为空气污染,水污染,土壤污染等。 ,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3 (aq) ΔH3 为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图
,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3 (aq) ΔH3 为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图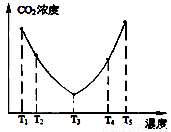
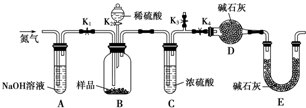
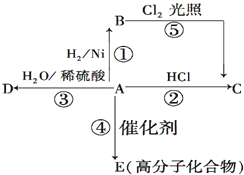 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应. (反应类型加聚反应 ).
(反应类型加聚反应 ).