题目内容
【题目】利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
i. CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii. CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
iii. CO2(g)+H2(g)![]() CO (g)+H2O(g) △H3
CO (g)+H2O(g) △H3
回答下列问题:
(1)已知反应ii中的相关的化学键键能(“C![]() O”表示CO的化学键)数据见表:
O”表示CO的化学键)数据见表:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H2=______________。
(2)反应i、ii、iii对应的平衡常数K1、K2、K3之间的关系式为_______________
(3)一定条件下,在2L的恒容密闭容器中充入1molCO2和2molH2发生反应i 。下图是反应体系中CO2的平衡转化率与温度的关系曲线。

①△H1_____0(填“大于”或“小于”)
②当温度为500K时,该反应10min达到平衡。0~10min时间内用CH3OH表示该反
应的化学反应速率为_____________________。
③若改充入1mol CO2和3mol H2,则图中的曲线会_________(填“上移”或“下移”)。
(4)在3 L容积可变的密闭容器中发生反应iii,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是______;当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_______。

(5)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质b是__________, 阳极电极反应为_______________。

【答案】 -99 kJ·mol-1 K1=K2·K3 小于 0.03mol/(L·min) 上移 加入催化剂 将容器的体积(快速)压缩至2L 甲醇(或CH3OH) 2Al+3H2O-6e- =Al2O3 +6H+
【解析】试题分析:分析i. CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1、ii. CO(g)+2H2(g)
CH3OH(g)+H2O(g) △H1、ii. CO(g)+2H2(g)![]() CH3OH(g) △H2 、iii. CO2(g)+H2(g)
CH3OH(g) △H2 、iii. CO2(g)+H2(g)![]() CO (g)+H2O(g) △H3等3个反应的关系可知,i = ii + iii 。
CO (g)+H2O(g) △H3等3个反应的关系可知,i = ii + iii 。
(1)反应热等于反应物的键能总和减去生成物的键能总和,所以,△H2=1076+436![]() -413
-413![]() -343-465=-99 kJ·mol-1。
-343-465=-99 kJ·mol-1。
(2)因为i = ii + iii,所以,由化学平衡常数的表达式可知,反应i、ii、iii对应的平衡常数K1、K2、K3之间的关系式为K1=K2·K3。
(3)由反应体系中CO2的平衡转化率与温度的关系曲线可知,CO2的平衡转化率随着温度的升高而减小,所以该反应为放热反应,故①△H1小于0。②当温度为500K时,该反应10min达到平衡。由图中数据可知,500K时CO2的平衡转化率为60%,则CO2的变化量为0.6mol,由该反应的化学方程式可知, CH3OH的变化量为0.6mol,所以,0~10min时间内用CH3OH表示该反应的化学反应速率为![]() 0.03mol/(L·min)。2L的恒容密闭容器中充入1molCO2和2molH2发生反应i CO2(g)+3H2(g)
0.03mol/(L·min)。2L的恒容密闭容器中充入1molCO2和2molH2发生反应i CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
③若改充入1mol CO2和3mol H2,由于增大了H2的浓度,CO2的平衡转化率升高,则图中的曲线会上移。
(4)在3 L容积可变的密闭容器中发生反应iii CO2(g)+H2(g)![]() CO (g)+H2O(g),该反应是一个气体分子数不变的反应。由图可知,当曲线Ⅰ变为曲线Ⅱ时,化学反应速率加快,CO的浓度逐渐增大,但是CO的平衡浓度没有改变,故改变的条件是加入催化剂;当曲线Ⅰ变为曲线Ⅲ时,化学反应速率加快,CO的浓度由2mol/L突然增大到3mol/L,故改变的条件是将容器的体积(快速)压缩至2L。
CO (g)+H2O(g),该反应是一个气体分子数不变的反应。由图可知,当曲线Ⅰ变为曲线Ⅱ时,化学反应速率加快,CO的浓度逐渐增大,但是CO的平衡浓度没有改变,故改变的条件是加入催化剂;当曲线Ⅰ变为曲线Ⅲ时,化学反应速率加快,CO的浓度由2mol/L突然增大到3mol/L,故改变的条件是将容器的体积(快速)压缩至2L。
(5)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程。根据实验目的,铝应作阳极,故a是氧气、b是甲醇,阳极上铝被氧化为氧化铝,电极反应为2Al+3H2O-6e- =Al2O3 +6H+。

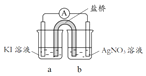
【题目】某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
(1)方案1:通过置换反应比较
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是_______,说明氧化性Ag+>Cu2+。
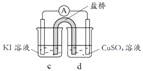
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
实验 | 试剂 | 编号及现象 | |
试管 | 滴管 | ||
| 1.0 mol/L KI溶液 | 1.0 mol/L AgNO3溶液 | Ⅰ.产生黄色沉淀,溶液无色 |
1.0 mol/L CuSO4溶液 | Ⅱ.产生白色沉淀A,溶液变黄 | ||
① 经检验,Ⅰ中溶液不含I2,黄色沉淀是________。
② 经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:
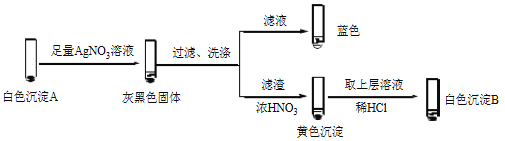
a.检验滤液无I2。溶液呈蓝色说明溶液含有________(填离子符号)。
b.白色沉淀B是________。
c.白色沉淀A与AgNO3溶液反应的离子方程式是____,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
编号 | 实验1 | 实验2 | 实验3 |
实验 |
|
|
|
现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极 上析出银;电流计指针偏转 | c中溶液较慢变浅黄色; 电流计指针偏转 |
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
① a中溶液呈棕黄色的原因是_______(用电极反应式表示)。
② “实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_______。
③ 方案2中,Cu2+能氧化I-,而Ag+未能氧化I-的原因:_______。
(资料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108)