题目内容
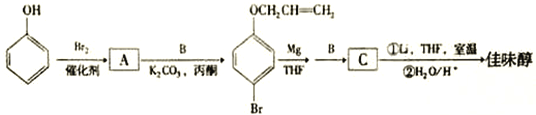
【题目】已知常温时CH3COOH的电离平衡常数Ka=1.75×105,NH3·H2O的电离平衡常数Kb=1.75×105。常温时,向10 mL浓度均为0.01mol·L1的NaOH和氨水混合溶液中,逐滴加入0.01mol·L1的 CH3COOH 溶液,混合溶液的pH与加入CH3COOH的体积V之间的变化曲线如图所示,下列有关说法正确的是

A. a 点溶液的pH<12
B. b 点时水的电离程度最大
C. c 点处的微粒间存在:c(CH3COO)=c(NH4+)+c(NH3·H2O)
D. d 点处的微粒间存在:c(CH3COO)>c(H+)>c(Na+)>c(NH4+)>c(OH)
【答案】B
【解析】试题分析:由醋酸和一水合氨的电离常数可知,两者在相同条件下的电离度相同,所以醋酸铵溶液显中性。A. a 点溶液中,浓度均为0.01mol·L1的NaOH和氨水混合溶液的pH>12,A不正确;B. b 点醋酸与溶液中的两种碱恰好完全反应,得到醋酸钠溶液和醋酸铵溶液的混合液,此时因为两种盐均能水解,可以促进水的电离,在b点前后都会有碱或酸抑制水的电离,所以b点水的电离程度最大,B正确;C. c 点pH=7,此时溶液中有醋酸、醋酸钠和醋酸铵3种溶质,由物料守恒可知,c(CH3COO)>c(NH4+)+c(NH3·H2O),C不正确;D. d 点处的溶液中含有物质的量相等的醋酸、醋酸钠和醋酸铵3种溶质,溶液是酸性,但是因为醋酸是弱电解质,而醋酸钠和醋酸铵均为强电解质,所以溶液中存在c(CH3COO)> c(Na+)>c(NH4+)>c(H+)>c(OH),D不正确。

练习册系列答案
相关题目