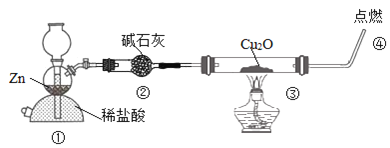
题目内容
【题目】某![]() 样品中含有
样品中含有![]() 和
和![]() 杂质,现欲制取纯净的
杂质,现欲制取纯净的![]() ,某同学设计如图的实验方案。请回答下列问题:
,某同学设计如图的实验方案。请回答下列问题:
实验方案:

(1)操作Ⅰ的名称是______,在该操作中用到的玻璃仪器除了有烧杯、玻璃棒,还有______。
(2)沉淀A的成分是______![]() 填化学式
填化学式![]() ,写出第③步反应中铝元素转化的离子方程式______。
,写出第③步反应中铝元素转化的离子方程式______。
(3)写出证明滤液B中![]() 已沉淀完全的实验方法______。
已沉淀完全的实验方法______。
(4)不改变上述流程图的结构,将“①过量盐酸”“②过量NaOH”交换位置,则“③过量![]() ”应改为__________,写出此方案下生成沉淀B的离子方程式______。
”应改为__________,写出此方案下生成沉淀B的离子方程式______。
(5)为了得到更加纯净的![]() ,过滤后需要进行操作步骤是______。
,过滤后需要进行操作步骤是______。
(6)写出工业由氧化铝冶炼铝的化学方程式______。
【答案】过滤 漏斗 SiO2 ![]() 取少量滤液B于试管中,滴加几滴KSCN溶液,振荡,溶液无明显变化 氨水或NH3
取少量滤液B于试管中,滴加几滴KSCN溶液,振荡,溶液无明显变化 氨水或NH3 ![]() 洗涤沉淀、干燥
洗涤沉淀、干燥 ![]()
【解析】
由分离提纯流程可知,氧化铝样品中含有氧化铁和二氧化硅杂质,加入过量盐酸,氧化铝与过量盐酸反应生成氯化铝,氧化铁和盐酸反应生成氯化铁,只有二氧化硅不与盐酸反应,沉淀A为![]() ,滤液A中为氯化铝、氯化铁、盐酸,则滤液A中加入过量NaOH,发生反应:H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,则沉淀B为
,滤液A中为氯化铝、氯化铁、盐酸,则滤液A中加入过量NaOH,发生反应:H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,则沉淀B为![]() ,滤液B中有
,滤液B中有![]() 、NaCl、NaOH,所以滤液B中的阴离子除了
、NaCl、NaOH,所以滤液B中的阴离子除了![]() 、
、![]() 外还有
外还有![]() ,通二氧化碳与
,通二氧化碳与![]() 反应生成氢氧化铝沉淀,最后加热Al(OH)3分解成氧化铝,以此来解答。
反应生成氢氧化铝沉淀,最后加热Al(OH)3分解成氧化铝,以此来解答。
(1)由上述分析可知,操作Ⅰ的名称是过滤,在该操作中用到的玻璃仪器除了有烧杯、玻璃棒,还有漏斗,
故答案为:过滤;漏斗;
(2)沉淀A为![]() ,第③步反应中铝元素转化的离子方程式为:
,第③步反应中铝元素转化的离子方程式为:![]() ,
,
故答案为:![]() ;
;![]() ;
;
(3)证明滤液B中![]() 已沉淀完全的实验方法为:取少量滤液B于试管中,滴加几滴KSCN溶液,振荡,溶液无明显变化,
已沉淀完全的实验方法为:取少量滤液B于试管中,滴加几滴KSCN溶液,振荡,溶液无明显变化,
故答案为:取少量滤液B于试管中,滴加几滴KSCN溶液,振荡,溶液无明显变化;
(4)不改变上述流程图的结构,将“①过量盐酸”“②过量NaOH”交换位置,滤液A含偏铝酸钠、硅酸钠,滤液B含氯化铝,沉淀B为硅酸,则“③过量CO2”应改为过量氨气或氨水,此方案下生成沉淀B的离子方程式为![]() ,
,
故答案为:过量氨气或氨水;![]() ;
;
(5)为了得到更加纯净的![]() ,过滤后需要进行操作步骤是洗涤沉淀、干燥,
,过滤后需要进行操作步骤是洗涤沉淀、干燥,
故答案为:洗涤沉淀、干燥;
(6)工业由氧化铝冶炼铝的化学方程式为:![]() ,
,
故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案