题目内容
【题目】某化学兴趣小组探究H2还原Cu2O,设计装置如图:下列说法不正确的是( )
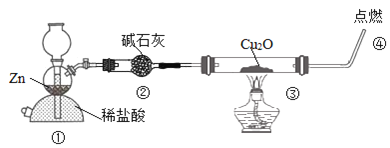
A.装置①也可用来制取CO2
B.装置②的作用之一是干燥氢气
C.通过③内固体颜色的变化判断反应是否完全
D.实验结束后,先熄灭酒精灯后停止通氢气
【答案】C
【解析】
探究H2还原Cu2O,由实验装置可知,①中Zn与盐酸反应生成氢气,②中碱石灰可除去氢气中的HCl、水蒸气,③中H2还原Cu2O生成Cu和水,反应结束后先熄灭酒精灯,继续通入一会氢气,防止生成的Cu被氧化,④点燃可检验纯度,以此来解答。
A.①为启普发生器,可实现固、液在不加热条件下反应制备气体,且不生成难溶物堵塞瓶颈处,可选碳酸钙、稀盐酸来制取CO2,A正确;
B.盐酸易挥发,装置②的作用之一是干燥氢气,B正确;
C.Cu为紫红色,Cu2O为砖红色,不能通过③内固体颜色的变化判断反应是否完全,C错误;
D.为防止生成的Cu被氧化,在实验结束后,先熄灭酒精灯后停止通氢气,D正确;
故合理选项是C。

【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)=2G(g)忽略固体体积,平衡时G的体积分数![]() 随温度和压强的变化如表所示:
随温度和压强的变化如表所示:
| 1.0 | 2.0 | 3.0 |
810 | 54.0 | a | b |
915 | c | 75.0 | d |
1000 | e | f | 83.0 |
①b>f ②915℃,2.0MPa时E的转化率为60% ③该反应的S>0 ④K(1000℃)>K(810℃)。上述中正确的有
A.4个B.3个C.2个D.1个
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图1所示,A中放有浓硫酸,B中放有无水乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl26C2H5OH。
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
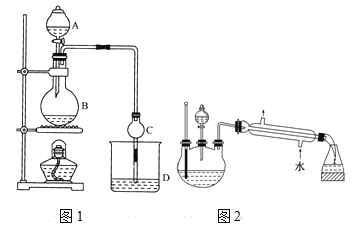
请回答:
(1)浓硫酸的作用是____;用同位素18O示踪法确定反应产物水分子中氧原子的提供者,若用18O标记乙醇分子中的氧原子,请写出该化学方程式:________。
(2)球形干燥管C的作用是_______。若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是_______。
(3)采用分液法从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,然后加入无水氯化钙,分离出________;再加入无水硫酸钠除去水,然后进行________(填操作名称),以得较纯净的乙酸乙酯。
(4)上述实验中饱和碳酸钠溶液的作用是______(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(5)另一化学课外小组对上述实验进行了改进,设计了图2所示的装置,利用浓硫酸、乙醇、乙酸制取乙酸乙酯(铁架台、铁夹、加热装置均已略去)与图1所示装置相比,此装置的主要优点有(写出一条即可)________。
(6)该实验中用30g乙酸与46g乙醇反应,如果实际得到的乙酸乙酯的质量是26.4g,则该实验中乙酸乙酯的产率是______。(产率指的是某种生成物的实际产量与理论产量的比值。已知乙醇、乙酸、乙酸乙酯的相对分子质量分别为:46、60、88)


