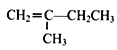题目内容
【题目】高锰酸钾是中学化学常用的试剂。主要用于防腐、化工、制药等。实验室模拟工业上用软锰矿制备高锰酸钾的流程如下:
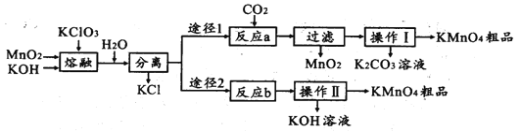
(1)实验室熔融二氧化锰、氧氧化钾、氯酸钾时应选择____________________________
a.普通玻璃坩埚 b.石英坩埚 c.陶瓷坩埚 d.铁坩埚
(2)第一步熔融时生成K2MnO4的化学方程式:______________________________________
(3)操作Ⅰ中根据KMnO4和K2CO3两物质在____________ (填性质)上的差异,采用浓缩结晶、趁热过滤得到KMnO4。趁热过滤的原因是______________________________________
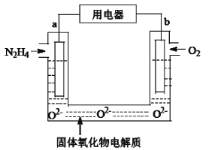
(4)反应b是电解法制备KMnO4,其装置如图所示,a作____________极(填“阳”或“阴”),中间的离子交换膜是_____ (填“阳”或“阴”)离子交换膜。阳极的电极反应式为____________
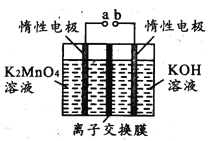
(5)取反应b后的电解液,加硫酸溶解后,用0.1000mol ·L-1FeSO4标准溶液滴定至终点时,消耗250.0mL标准溶液,则电解后溶液中的KMnO4的质量是_________g。
(6)两种途径的制备方法,途径1与途径2理论产率之比为_________
(7)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是________(填标号)。
a.双氧水 b.84消液(NaClO溶液) c.75%酒精 d.苯酚
【答案】D 3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O 溶解性 避免温度下降,造成主产品的纯度降低 阳 阳 MnO42--e-==MnO4- 0.79 2:3 ab
3K2MnO4+KCl+3H2O 溶解性 避免温度下降,造成主产品的纯度降低 阳 阳 MnO42--e-==MnO4- 0.79 2:3 ab
【解析】
在工业流程中,原料中的MnO2、KOH、KClO3发生如下反应:
3MnO2+6KOH+KClO3![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
在途径1中发生反应为:3K2MnO4+2CO2=MnO2+2KMnO4+2K2CO3,
在途径2中发生反应为:2K2MnO4+2H2O![]() 2KMnO4+2KOH+H2↑。
2KMnO4+2KOH+H2↑。
(1)因为KOH能与SiO2反应,所以实验室熔融二氧化锰、氧氧化钾、氯酸钾时,应选择不含SiO2成分的坩埚,只能选择铁坩埚,答案为D;
(2)由前面分析知,第一步熔融时生成K2MnO4的化学方程式为:
3MnO2+6KOH+KClO3![]() 3K2MnO4+KCl+3H2O,
3K2MnO4+KCl+3H2O,
答案为3MnO2+6KOH+KClO3![]() 3K2MnO4+KCl+3H2O;
3K2MnO4+KCl+3H2O;
(3) 采用浓缩结晶、趁热过滤方法得到KMnO4,应利用两者的溶解性差异;趁热过滤的原因是防止过滤过程中因温度降低导致K2CO3结晶析出。答案为:溶解性;避免温度下降,造成主产品的纯度降低;
(4) 反应b是电解法制备KMnO4,在a电极上,K2MnO4失电子转化为KMnO4,所以a电极应为阳极;转化后多出的K+将通过交换膜进入阴极,所以交换膜应为阳离子交换膜;阳极的电极反应式为MnO42--e-=MnO4-,答案为阳极;阳离子交换膜;MnO42--e-=MnO4-;
(5) 利用得失电子守恒,可建立如下关系式:
KMnO4——5FeSO4
1mol 5mol
0.005mol 0.025mol
m(KMnO4)= 0.005mol×158g/mol=0.79g,答案为0.79;
(6)在途径1中发生反应为:3K2MnO4+2CO2=MnO2+2KMnO4+2K2CO3,K2MnO4转化率为2/3,在途径2中发生反应为:2K2MnO4+2H2O![]() 2KMnO4+2KOH+H2↑,K2MnO4转化率为1,途径1与途径2理论产率之比为2/3 : 1=2 : 3,答案为2 : 3;
2KMnO4+2KOH+H2↑,K2MnO4转化率为1,途径1与途径2理论产率之比为2/3 : 1=2 : 3,答案为2 : 3;
(7) KMnO4稀溶液作消毒剂时,表现出强氧化性,其消毒原理与双氧水、84消液(NaClO溶液)相同,答案为ab。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案