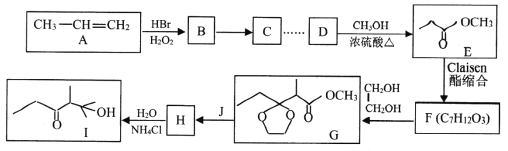
题目内容
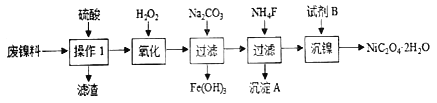
【题目】A、B、C、D、E、F为前四周期元素,且原子序数依次增大。A是元素周期表中半径最小的元素,B的基态原子2p轨道上未成对电子数是C的3倍;D的基态原子含13种运动状态不同的电子;E与A位于同一主族;F2+的3d轨道中有9个电子。(答题时用字母对应的元素符号表示)
⑴元素A、B、C的电负性由大到小的顺序为______。
⑵F的基态原子价层电子排布式为______。
⑶BC3的空间构型为______,与BC3互为等电子体的一种阴离子的化学式为______。
⑷一种化合物X的晶体结构如图,X的化学式为______。 (图中○:E+,●:DC![]() )
)
⑸化合物AC与EC中熔点更高的是_________,原因是________。
【答案】F、N、H 3d104s1 三角锥形 SO32- K3AlF6 KF KF是离子晶体,HF是分子晶体,离子键的作用强于分子间作用力
【解析】
A、B、C、D、E、F为前四周期元素,且原子序数依次增大。A是元素周期表中半径最小的元素,则A为H元素;B的基态原子2p轨道上未成对电子数是C的3倍,p轨道最多为3个未成对的电子,则B的基态原子核外电子排布式为1s22s22p3,C的基态原子核外电子排布式为1s22s22p5,故B为N元素,C为F元素;D的基态原子含13种运动状态不同的电子,则D为Al元素;E与A位于同一主族,则E为K元素;F2+的3d轨道中有9个电子,则F的价层电子排布式为3d104s1,故F为Cu元素。
(1)元素A、B、C分别为H、N、F,非金属性越强,电负性越强,非金属性:F>N>H,电负性由大到小的顺序为F、N、H,
答案为:F、N、H;
⑵F为Cu元素,基态原子价层电子排布式为3d104s1,
答案为:3d104s1;
⑶BC3为NF3,根据价层电子互斥理论,价层电子对数为3+![]() (5-3)=4,则空间构型为三角锥型;NF3由四个原子组成,最外层电子数之和为26,与NF3互为等电子体的一种阴离子的化学式为SO32-,
(5-3)=4,则空间构型为三角锥型;NF3由四个原子组成,最外层电子数之和为26,与NF3互为等电子体的一种阴离子的化学式为SO32-,
答案为:三角锥形;SO32-;
⑷如图所示,E+的数目为9+12×![]() =12个,DC
=12个,DC![]() 的数目为8×
的数目为8×![]() +6×
+6×![]() =4,可得:E+与DC
=4,可得:E+与DC![]() 的数目之比为3:1,根据化合物中化合价之和为0,则(+1)×3+(-1)×n=0,n=3,即DC
的数目之比为3:1,根据化合物中化合价之和为0,则(+1)×3+(-1)×n=0,n=3,即DC![]() 为AlF
为AlF![]() ,F在化合物中只有-1价,Al为+3价,则3+(-1)×m=-3,故m=6,因此X的化学式为K3AlF6,
,F在化合物中只有-1价,Al为+3价,则3+(-1)×m=-3,故m=6,因此X的化学式为K3AlF6,
答案为:K3AlF6;
⑸化合物AC为HF,EC为KF,HF为分子晶体,KF为离子晶体,离子键的作用强于分子间作用力,故熔点更高的是KF,
答案为:KF;HF为分子晶体,KF为离子晶体,离子键的作用强于分子间作用力。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案