��Ŀ����
����Ŀ��ijҺ̬��(N2H4)ȼ�ϵ�ر��㷺Ӧ���ڷ���ͨѶ���ǡ�ս�Ե��������ػ���С������Թ���������Ϊ����ʣ�������Ϊ���������ʡ������йظõ�ص�˵����ȷ����
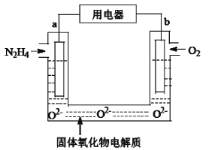
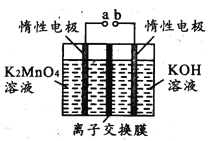
A.b����������������ԭ��Ӧ
B.��ص�·�У��������缫a���õ������缫b
C.���缫a.������1 mol N2H4ʱ���缫b�ϱ�������O2�ڱ�״�������Ϊ11.2 L
D.b��������pHֵ���
���𰸡�A
��������
�õ���ܷ�ӦΪ��N2H4+O2=N2��+2H2O��ȼ�ϵ���У�������ȼ��ʧ���ӣ�����������Ӧ�������������õ��ӷ�����ԭ��Ӧ���ɾݴ˻ش�
A����ȼ�ϵ���У�������ȼ��ʧ���ӷ���������Ӧ�������������õ��ӷ�����ԭ��Ӧ����A��ȷ��
B����ȼ�ϵ���У�ͨ��ȼ�ϵ�һ��Ϊ����ͨ��������һ��Ϊ���������·�е������������������������ǣ��缫b���õ������缫a����B����
C���ɵ���ܷ�ӦΪN2H4+O2=N2��+2H2O��֪�����缫a����1mol N2H4����ʱ��b�缫����1mo O2����ԭ������������22.4L����C����
D��b�缫�����ķ�ӦΪ��O2+4e-=2O2-��b��������pHֵû�б仯����D����
�ʴ�ΪA��

 ��ĩ��ϰ���ϵ�д�
��ĩ��ϰ���ϵ�д� ����ѧ�䵥Ԫ������ĩר����100��ϵ�д�
����ѧ�䵥Ԫ������ĩר����100��ϵ�д� �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д� ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д�����Ŀ�������ˮ��Һ�д��ڵ���ƽ�⡢ˮ��ƽ�⡢�ܽ�ƽ�⣬��ش��������⡣
��1����֪��������ĵ��볣�����±���
���� | CH3COOH | HCN | H2CO3 |
���볣��(25��) | Ka = 1.8��10-5 | Ka=4.3��l0-10 | Ka1=5.0��l0-7 Ka2=5.6��l0-11 |
��0.1 moI/L NaCN��Һ��0.1mol/L NaHCO3��Һ�У�c(CN-)______c(HCO3-)(����>������<������=��)��
�ڳ����£����ʵ���Ũ����ͬ��������Һ��A��CH3COONa B��NaCN C��Na2CO3����pH�ɴ�С��˳����________(����)��
�۽�����CO2ͨ��NaCN��Һ����Ӧ�����ӷ���ʽ��__________��
�������£�����Ũ�ȵ�CH3COONa��ҺpH=9�������ӷ���ʽ��ʾ��Һ�ʼ��Ե�ԭ����______����Һ��c(CH3COO-)/c(CH3COOH) =________��
��2��ij�¶���, PH=3��������[OH-]=10-9 mol/L. ���¶���, PH=2��H2SO4��PH=11��NaOH��Ϻ�PH��Ϊ9,���������������Ƶ������Ϊ______.
��3�������£���0.100 mol/L������Һ�ζ�20.00mL 0.l00mol/L ��ij��ˮ��Һ���ζ�������ͼ��ʾ��������Ϊ������������

��d����ʾ����Һ������Ũ���ɴ�С��˳������Ϊ_____��
��b����ʾ����Һ��c(NH4+)��c(NH3��H2O)=______(д��ȷ��ֵ)��
��4����SO2����ˮ�γɵĶ�Ԫ������Һ�У���SԪ�ص�ij��ռ���к�SԪ���������ʵ�����������ҺpH�Ĺ�ϵ����ͼ��ʾ�������Ļ�ѧʽΪ_______���ö�Ԫ�����һ�����볣��ΪKa1����pKa1=-lgKa1��____��