题目内容
【题目】二碳化学的研究在工业生产中具有重要意义。
(1)在一定温度和压强下,已知:
化学键 | C—H | C—O | O—H | C===O | O===O | C—C |
键能/(kJ·mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
①CH3CH2OH(g)+1/2O2(g)![]() CH3CHO(g)+H2O(g) ΔH1=________。
CH3CHO(g)+H2O(g) ΔH1=________。
②若反应2CH3CHO(g)+O2(g)![]() 2CH3COOH(g)可自发进行,则CH3CH2OH(g)+O2(g)
2CH3COOH(g)可自发进行,则CH3CH2OH(g)+O2(g)![]() CH3COOH(g)+H2O(g) ΔH2________(填“>”“<”或“=”)0。
CH3COOH(g)+H2O(g) ΔH2________(填“>”“<”或“=”)0。
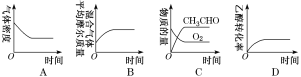
(2)将一定量的CH3CH2OH和O2充入恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g)![]() 2CH3CHO(g)+2H2O(g)至平衡状态。下列图象不合理的是________(填字母)。
2CH3CHO(g)+2H2O(g)至平衡状态。下列图象不合理的是________(填字母)。
(3)已知:25 ℃,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)=1.75×10-5,![]() ≈1.3,lg 1.3≈0.1。
≈1.3,lg 1.3≈0.1。
①25 ℃,0.1 mol·L-1CH3COOH溶液的pH=______;将0.1 mol·L-1CH3COOH溶液与0.1 mol·L-1的氨水等体积混合,所得溶液中离子浓度大小关系为_______________________________。
②25 ℃,0.2 mol·L-1NH4Cl溶液中NH4+水解反应的平衡常数Kh=________。(保留2位有效数字)
③25 ℃,向0.1 mol·L-1氨水中加入少量NH4Cl固体,NH3·H2O![]() NH4++OH-的电离平衡________(填“正向”“逆向”或“不”)移动;请用氨水和某种铵盐(其他试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质____________________________________。
NH4++OH-的电离平衡________(填“正向”“逆向”或“不”)移动;请用氨水和某种铵盐(其他试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质____________________________________。
【答案】-203 kJ·mol-1 < B 2.9 c(CH3COO-)=c(NH4+)>c(H+)=c(OH-) 5.7×10-10 逆向 取少量氨水于试管中,滴加2~3滴酚酞溶液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅,证明NH3·H2O是弱电解质(或其他合理答案)
【解析】
(1)①根据反应的焓变等于反应物的键能和减去生成物的键能和进行计算;
②根据△G=△H2-T△S<0进行分析;
(2)根据图像进行分析;
(3)根据Ka(CH3COOH)计算溶液的pH值,等浓度等体积的CH3COOH溶液和的氨水混合恰好生成CH3COONH4,结合电荷守恒式得出结果;
(4)向0.1 mol·L-1氨水中加入少量NH4Cl固体,溶液中NH4+浓度增大,NH3·H2O![]() NH4++OH-的电离平衡逆向移动;欲证明NH3·H2O是弱电解质,可取少量氨水于试管中,滴加2~3滴酚酞试液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅,即可证明NH3·H2O是弱电解质。
NH4++OH-的电离平衡逆向移动;欲证明NH3·H2O是弱电解质,可取少量氨水于试管中,滴加2~3滴酚酞试液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅,即可证明NH3·H2O是弱电解质。
(1)①根据反应的焓变等于反应物的键能和减去生成物的键能和可知:CH3CH2OH(g)+1/2O2(g)![]() CH3CHO(g)+H2O(g) △H1=(414×5+332+464+326+498×1/2)kJ·mol-1-(414×4+332+728+464×2)kJ·mol-1=-203kJ·mol-1,故答案为:-203kJ·mol-1。
CH3CHO(g)+H2O(g) △H1=(414×5+332+464+326+498×1/2)kJ·mol-1-(414×4+332+728+464×2)kJ·mol-1=-203kJ·mol-1,故答案为:-203kJ·mol-1。
②已知2CH3CHO(g)+O2(g)![]() 2CH3COOH(g)的△S<0,若2CH3CHO(g)+O2(g)
2CH3COOH(g)的△S<0,若2CH3CHO(g)+O2(g) ![]() 2CH3COOH(g)反应可自发进行,则△G=△H2-T△S<0,故△H2<0;
2CH3COOH(g)反应可自发进行,则△G=△H2-T△S<0,故△H2<0;
故答案为:<。
(2)
A.气体的总质量不变,混合气体的体积增大,则密度先减小后不变,故A正确;
B.气体的总质量不变,混合气体的总物质的最变大,平衡摩尔质量逐渐变小,最终不变,故B错误;
C.随反应的进行,反应物的量逐渐减小,生成物的量逐渐增大,最终不变,故C正确;
D.反应物的转化率未平衡前增大,平衡后不变,故D正确。
故答案为:B。
(3)①已知CH3COOH![]() CH3COO-+H+,25℃,0.lmol·L-1CH3COOH溶液中Ka(CH3COOH)=[c(H+)×c(CH3COO-)]÷c(CH3COOH)=1.75×10-5,则c(H+)2=1.75×10-5÷c(CH3COOH)=1.75×10-5÷0.1mol/L=1.75×10-6,c(H+)=
CH3COO-+H+,25℃,0.lmol·L-1CH3COOH溶液中Ka(CH3COOH)=[c(H+)×c(CH3COO-)]÷c(CH3COOH)=1.75×10-5,则c(H+)2=1.75×10-5÷c(CH3COOH)=1.75×10-5÷0.1mol/L=1.75×10-6,c(H+)=![]() ×10-3mol/L=1.3×10-3mol/L,此时溶液的pH=3-lg1.3=2.9;
×10-3mol/L=1.3×10-3mol/L,此时溶液的pH=3-lg1.3=2.9;
CH3COOH的电离能力和NH3·H2O相同,则CH3COO-和NH4+水解能力也相同,则CH3COONH4溶液显中性,等浓度等体积的CH3COOH溶液和的氨水混合恰好生成CH3COONH4,结合电荷守恒式c(CH3COO-)+c(OH-)=c(NH4+)+c(H+),所得溶液中离子浓度大小关系为c(CH3COO-)=c(NH4+)>c(H+)=c(OH-);
故答案为:2.9,c(CH3COO-)=c(NH4+)>c(H+)=c(OH-)。
②已知NH4++H2O![]() NH3·H2O+H+,此时Kh=Kw÷Kb(NH3·H2O)=1×10-14÷1.75×10-5=5.7×10-10,
NH3·H2O+H+,此时Kh=Kw÷Kb(NH3·H2O)=1×10-14÷1.75×10-5=5.7×10-10,
故答案为:5.7×10
③25℃,向0.1 mol·L-1氨水中加入少量NH4Cl固体,溶液中NH4+浓度增大,NH3·H2O![]() NH4++OH-的电离平衡逆向移动;欲证明NH3·H2O是弱电解质,可取少量氨水于试管中,滴加2~3滴酚酞试液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅,即可证明NH3·H2O是弱电解质,故答案为:逆向;取少量氨水于试管中,滴加2~3滴酚酞溶液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅,证明NH3·H2O是弱电解质(或其他合理答案)。
NH4++OH-的电离平衡逆向移动;欲证明NH3·H2O是弱电解质,可取少量氨水于试管中,滴加2~3滴酚酞试液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅,即可证明NH3·H2O是弱电解质,故答案为:逆向;取少量氨水于试管中,滴加2~3滴酚酞溶液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅,证明NH3·H2O是弱电解质(或其他合理答案)。

【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
T(K) | 938 | 1 100 |
K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量______;充入氦气,混合气体的密度____(填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列五种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①用等式表示Na2CO3溶液中含有H+ 、OH- 、HCO3-、H2CO3微粒间的关系_________。
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是________;将各溶液分别稀释100倍,pH变化最小的是________(填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
③要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为_____________________________________。
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:

容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06molN2和0.12 molCO2,则达平衡时N2的转化率大于40%