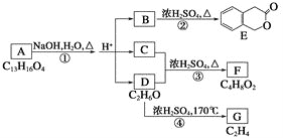
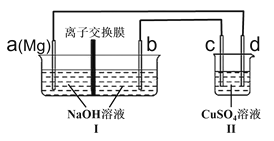
题目内容
【题目】全固态锂硫电池是一种新型电池,其能量密度约为一般电子设备中广泛使用的锂离子电池的4倍,且成本更低廉。已知锂硫电池的总反应为![]() ,用此电池作电源电解足量的
,用此电池作电源电解足量的![]() 溶液,其工作原理如图所示。下列有关说法正确的是( )
溶液,其工作原理如图所示。下列有关说法正确的是( )
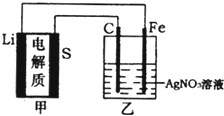
A.乙池溶液中的NO3![]() 移向铁电极
移向铁电极
B.乙池石墨电极反应式为![]()
C.甲池充电时,锂电极发生氧化反应
D.甲池中消耗14g锂,乙池中产生![]() 氧气
氧气![]() 标准状况下
标准状况下![]()
【答案】D
【解析】
A.甲为原电池,其中Li电极为负极,所连接的Fe电极为阴极,S电极为正极,所连接的C电极为阳极,电解池中![]() 移向阳极
移向阳极![]() 电极
电极![]() ,故A错误;
,故A错误;
B.石墨电极为阳极,其电极反应式为![]() ,故B错误;
,故B错误;
C.甲池充电时,Li电极为阴极,![]() 得电子发生还原反应,故C错误;
得电子发生还原反应,故C错误;
D.根据得失电子守恒有![]() ,甲池中消耗14g锂,乙池产生
,甲池中消耗14g锂,乙池产生![]() 的物质的量为
的物质的量为![]() ,故D正确。
,故D正确。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案【题目】盐在化学工业中有重要的应用,请回答下列问题。
(1)用离子方程式表示FeCl3可作净水剂的原因:______________________________。
(2)常温下,在pH=3的硫酸与pH =11的Na2S溶液中,水电离出来的c(OH-)之比为_______
(3)物质的量浓度相等的下列溶液①NH4Cl②NH4 HSO4③(NH4 ) 2SO4④CH3 COONH4⑤NH3 H2O,溶液中的C(NH4 +)由大到小的顺序是__________________(用序号表示)。
(4)25℃,两种酸的电离平衡常数如下表:
Ka1 | Ka2 | |
H2SO3 | 1.3x10-2 | 6.3x10-8 |
H2CO3 | 4.2x10-7 | 5.6x10-11 |
①0.10 mol L-1NaHSO3溶液中离子浓度由大到小的顺序为__________________
②向NaHCO3溶液中通入少量二氧化硫时反应的离子方程式为__________________________
(5)已知 25 ℃ 时 Ksp[Mg(OH)2] =1.8×10-11, Ksp[Cu(OH)2] =2.2 ×10-20.25 ℃时,向浓度均为0.1 mol L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________(填化学式)沉淀;当体系中两种沉淀共存时,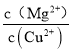 =_______。
=_______。