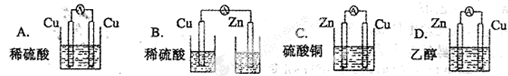
题目内容
钛被称为21世纪金属。研究发现,用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图所示装置制备金属钛。下列叙述正确的是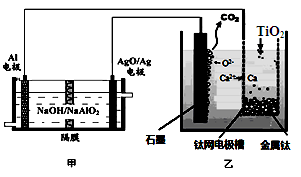
| A.乙装置阴极的电极反应式为 TiO2+4e-=Ti+2O2- |
| B.若不考虑能量的损失,制备24.0g 金属钛,需要消耗金属铝36.0g |
| C.甲装置工作过程中OH-向AgO/Ag极移动;乙装置工作过程中O2-向钛网移动 |
| D.乙装置中的石墨电极需要定期更换 |
D
解析试题分析:根据题给装置知,甲池为原电池,Al电极为负极,被氧化,AgO/Ag电极为正极,发生还原反应,乙为电解装置,阳极上电极反应式为C+2O2--4e-═CO2↑,阴极上电极反应式为:2Ca2++4e-═2Ca,钙与二氧化钛发生反应:2Ca+TiO2=Ti+2CaO。A、乙装置阴极的电极反应式为2Ca2++4e-═2Ca、2Ca+TiO2=Ti+2CaO,错误;B、n(Ti)=0.5mol,则消耗1molCa,转移2mol电子,由电极方程式Al+4OH---3e-═AlO2-+2H2O可知,需要2/3molAl,质量为18g,错误;C、甲装置工作过程中OH-向负极移动,即向Al极移动,错误;D、因乙装置中的石墨电极不断被消耗,则乙装置中的石墨电极需要定期更换,正确。
考点:考查原电池原理和电解原理的应用。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al + 3O2 + 6H2O = 4Al(OH)3,下列说法不正确的是( )
| A.正极反应式为:O2 + 2H2O + 4e- = 4OH- |
| B.电池工作时,电流由铝电极沿导线流向铂电极 |
| C.以网状的铂为正极,可增大与氧气的接触面积 |
| D.该电池通常只需更换铝板就可继续使用 |
储氢合金表面镀铜过程发生反应Cu2++2HCHO+4OH-=Cu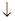 +H2
+H2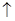 +2H2O+2HCOO-,下列说法错误的是
+2H2O+2HCOO-,下列说法错误的是
| A.电镀过程中氢气在镀件表面析出 |
| B.电镀时溶液中Cu2+移向阴极,并在阴极上发生还原反应 |
| C.阳极反应式为HCHO+3OH--2e-=2H2O+HCOO- |
| D.电镀时每生成6.4g铜镀层放出2.24L H2 |
氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH-下列叙述不正确的是( )
| A.H2通入负极区 | B.O2通入正极区 |
| C.负极发生氧化反应 | D.正极发生氧化反应 |
下列反应能设计成原电池提供电能的是
| A.Cu与Cl2燃烧反应 | B.Ba(OH)2·8H2O与NH4Cl反应 |
| C.灼热的炭与CO2反应 | D.氢氧化钠溶液与稀盐酸反应 |
用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( )
| A.1 mol·L-1 | B.2 mol·L-1 | C.3 mol·L-1 | D.4 mol·L-1 |
乙醛酸(OHCCOOH)是合成名贵高档香料乙基香兰素 的原料之一,可用草酸(HOOCCOOH)电解制备,装置如图所示。下列说法不正确的是( )
| A.电解时石墨电极应与直流电的正极相连 |
| B.阴极反应式为:HOOCCOOH+2H++2e-=OHCCOOH+H2O |
| C.电解时石墨电极上有O2放出 |
| D.电解一段时间后,硫酸溶液的pH不变化 |
下列各组材料中,不能组成原电池的是 ( )
| | A | B | C | D |
| 两极材料 | Zn片、石墨 | Cu片、Ag片 | Zn片、Cu片 | Fe片、Cu片 |
| 插入溶液 | 硫酸溶液 | 硝酸银溶液 | 蔗糖溶液 | 稀盐酸 |