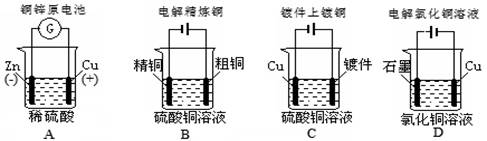
题目内容
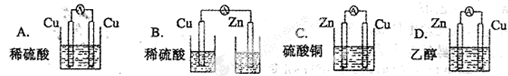
将纯锌片和纯铜片按图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是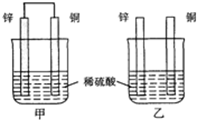
| A.两烧杯中溶液的pH均增大 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中铜片表面均无气泡产生 |
| D.甲、乙溶液均变蓝色 |
A
解析试题分析:A.两烧杯中Zn都与硫酸发生反应使溶液中的H+的浓度减小,所以溶液的pH均增大,正确;B.在甲中构成了原电池,铜片是正极,而在乙中没有形成原电池,错误;C.在甲烧杯中Cu作正极,铜片表面有气泡产生,而在乙烧杯中铜片表面均气泡产生,错误;D.甲、乙溶液逐渐变为无色的硫酸锌溶液,错误。
考点:考查原电池的构成条件、反应原理及实验现象的知识。

练习册系列答案
相关题目
下列有关电化学原理的说法错误的是( )
| A.氯化铝的熔点比氧化铝低,因此工业上最好采用电解熔融氯化铝来制备单质铝 |
| B.电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极 |
| C.对于冶炼像钠、钙、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法 |
| D.对大型船舶的外壳进行的“牺牲阳极的阴极保护法”,是应用了原电池原理 |
关于下列各装置图的叙述中,不正确的是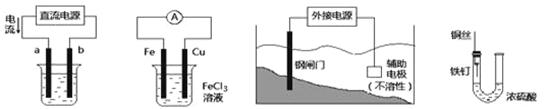
① ② ③ ④
| A.用装置①在铁件上镀铜,则a极为铜,电解质为CuSO4溶液 |
| B.装置②的总反应是:Fe +2Fe3+=3Fe2+ |
| C.装置③中钢闸门应与外接电源的正极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是 ( )
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O |
氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH-下列叙述不正确的是( )
| A.H2通入负极区 | B.O2通入正极区 |
| C.负极发生氧化反应 | D.正极发生氧化反应 |
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
| A.原混合溶液中c(K+)为1 mol·L-1 | B.上述电解过程中共转移4 mol电子 |
| C.电解得到的Cu的物质的量为0.5 mol | D.电解后溶液中c(H+)为2 mol·L-1 |