题目内容
【题目】如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是
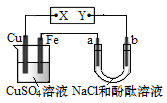
A.X是负极,Y是正极
B.CuSO4溶液的pH减小
C.a极产生的气体能使湿润的红色石蕊试纸先变红后褪色
D.若电路中转移了0.02 mol e-,Fe电极增重0.64g
【答案】CD
【解析】
a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则b电极上氢离子放电生成氢气,同时电极附近有氢氧根离子生成,则b是阴极、a是阳极,所以Y是负极、X是正极,Cu是阳极,Fe是阴极,电解时,阳极上Cu失电子变成Cu2+、阴极上铜离子得电子,据此分析解答。
a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则b电极上氢离子放电生成氢气,同时电极附近有氢氧根离子生成,则b是阴极、a是阳极,所以Y是负极、X是正极,Cu是阳极,Fe是阴极,电解时,阳极上Cu失电子变成Cu2+、阴极上铜离子得电子。
A. 通过以上分析知,Y是负极、X是正极,故A错误;
B. 电解时,左边装置阳极上为Cu失电子变成Cu2+,阴极Fe上为Cu2+得到电子被还原成Cu,所以CuSO4溶液的pH不变,故B错误;
C. a是阳极,电解质溶液中的氯离子失电子,a极产生氯气,氯气与水反应生成盐酸和次氯酸,湿润的红色石蕊试纸先变红后褪色,故C正确;
D. Fe是阴极,阴极上铜离子得电子生成铜单质,电极反应为Cu2++2e-=Cu,若电路中转移了0.02 mol e-时,Fe电极上生成0.01mol的铜单质,质量为0.64g, Fe电极增重0.64g,故D正确;
答案选CD。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目