题目内容
【题目】纯碱工业是基本无机化工之一。完成下列填空:
(1)常温下向纯碱溶液中滴加酚酞试液,溶液变红,原因是___(用离子方程式表示);继续滴加足量氯化钡溶液,可以看到__。
(2)最早的勒布朗法制碱涉及如下反应:Na2SO4+2C+CaCO3![]() Na2CO3+CaS+2CO2↑。该反应中被还原的元素是___。若转移6.02×1024个电子,生成CO2在标准状况下的体积为__L。
Na2CO3+CaS+2CO2↑。该反应中被还原的元素是___。若转移6.02×1024个电子,生成CO2在标准状况下的体积为__L。
(3)索尔维法(氨碱法)是工业生产纯碱的主要方法,其主要原理可以表示为:NaCl(饱和)+H2O+CO2+NH3=NaHCO3↓+NH4Cl。该反应涉及的各物质中,属于弱电解质的是___。综合平衡理论解释通入CO2和NH3后为何会有NaHCO3析出___。
(4)侯德榜对索尔维法进行了改进,利用平衡移动原理从析出NaHCO3后的母液中提取NH4Cl产品,所需的物质有___(填化学式)。
(5)纯碱厂在生产过程中要时刻关注设备的腐蚀情况。输送饱和食盐水的铸铁管道受到腐蚀时,正极的电极反应方程式为:___。为缓解腐蚀,可在铸铁管道上固定铝-锌-镉三元合金,该方法称为___。
【答案】CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH- 产生白色沉淀,溶液红色变浅直至变为无色 Na2SO4中+6价S元素 56 H2O 通入CO2和NH3后,溶液中HCO
+OH- 产生白色沉淀,溶液红色变浅直至变为无色 Na2SO4中+6价S元素 56 H2O 通入CO2和NH3后,溶液中HCO![]() 物质的量浓度增大,使NaHCO3溶解平衡NaHCO3(s)
物质的量浓度增大,使NaHCO3溶解平衡NaHCO3(s)![]() Na+(aq)+HCO
Na+(aq)+HCO![]() (aq)平衡逆向移动,析出NaHCO3晶体 NH3、NaCl O2+2H2O+4e-═4OH- 牺牲阳极的阴极保护法
(aq)平衡逆向移动,析出NaHCO3晶体 NH3、NaCl O2+2H2O+4e-═4OH- 牺牲阳极的阴极保护法
【解析】
(1)加酚酞变红,说明溶液显碱性,原因是碳酸根离子水解,水解的离子方程式为:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-。加足量氯化钡,Ba2+和CO
+OH-。加足量氯化钡,Ba2+和CO![]() 反应生成BaCO3沉淀,碳酸根离子水解平衡向左移动,OH-浓度减小,红色变浅直至变为无色,故答案为:CO
反应生成BaCO3沉淀,碳酸根离子水解平衡向左移动,OH-浓度减小,红色变浅直至变为无色,故答案为:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-;产生白色沉淀,溶液红色变浅直至变为无色;
+OH-;产生白色沉淀,溶液红色变浅直至变为无色;
(2)Na2SO4中+6价的S变为CaS中-2价的S,被还原,1mol Na2SO4参与反应转移8mol电子。6.02×1024个电子的物质的量=10mol,则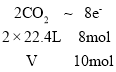 ,解得V=56L,故答案为:Na2SO4中+6价的S元素;56;
,解得V=56L,故答案为:Na2SO4中+6价的S元素;56;
(3)NaCl、NaHCO3、NH4Cl是强电解质,H2O是弱电解质,CO2、NH3是非电解质。通入CO2和NH3后,溶液中HCO![]() 物质的量浓度增大,使NaHCO3溶解平衡NaHCO3(s)
物质的量浓度增大,使NaHCO3溶解平衡NaHCO3(s)![]() Na+(aq)+HCO
Na+(aq)+HCO![]() (aq)平衡逆向移动,析出NaHCO3晶体,故答案为:H2O;通入CO2和NH3后,溶液中HCO
(aq)平衡逆向移动,析出NaHCO3晶体,故答案为:H2O;通入CO2和NH3后,溶液中HCO![]() 物质的量浓度增大,使NaHCO3溶解平衡NaHCO3(s)
物质的量浓度增大,使NaHCO3溶解平衡NaHCO3(s)![]() Na+(aq)+HCO
Na+(aq)+HCO![]() (aq)平衡逆向移动,析出NaHCO3晶体;
(aq)平衡逆向移动,析出NaHCO3晶体;
(4)由NH4Cl(s)![]() NH4+(aq)+Cl-(aq)可知,要提取NH4Cl产品,需增大NH4+和Cl-的浓度,所需物质为NH3和NaCl,故答案为:NH3、NaCl;
NH4+(aq)+Cl-(aq)可知,要提取NH4Cl产品,需增大NH4+和Cl-的浓度,所需物质为NH3和NaCl,故答案为:NH3、NaCl;
(5)NaCl溶液显中性,铸铁发生吸氧腐蚀,正极反应为:O2+2H2O+4e-=4OH-,为缓解腐蚀,可在铸铁管道上固定铝-锌-镉三元合金,Al、Zn都比Fe活泼,作负极,Fe作正极被保护,该方法称为牺牲阳极的阴极保护法,故答案为:O2+2H2O+4e-=4OH-;牺牲阳极的阴极保护法。

 阅读快车系列答案
阅读快车系列答案