题目内容
某研究小组探究SO2和Fe(NO3)3溶液的反应。
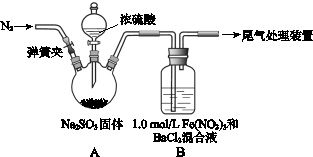
已知: 1.0 mol·L-1的Fe(NO3)3溶液的pH=1,请回答:
(1)装置A中反应的化学方程式是 。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是 。
(3)装置B中产生了白色沉淀,其成分是 ,说明SO2具有 性。
(4)分析B中产生白色沉淀的原因:
观点1: _____________________________;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①若观点2正确,装置B中反应的离子方程式是 。
②只需将装置B中的 Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,即可证明观点3是否正确,应选择的试剂是(填序号) 。
a.0.1 mol·L-1稀硝酸
b.1.5 mol·L-1 Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol/L盐酸等体积混合的溶液

已知: 1.0 mol·L-1的Fe(NO3)3溶液的pH=1,请回答:
(1)装置A中反应的化学方程式是 。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是 。
(3)装置B中产生了白色沉淀,其成分是 ,说明SO2具有 性。
(4)分析B中产生白色沉淀的原因:
观点1: _____________________________;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①若观点2正确,装置B中反应的离子方程式是 。
②只需将装置B中的 Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,即可证明观点3是否正确,应选择的试剂是(填序号) 。
a.0.1 mol·L-1稀硝酸
b.1.5 mol·L-1 Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol/L盐酸等体积混合的溶液
(12分)
(1)Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O(2分)
(2)打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹(2分)
(3)BaSO4(1分) 还原性(1分)
(4)观点1:SO2和Fe3+、酸性条件下NO3-都反应(2分)
①SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+(2分;可分两步写,各1分)
②c(2分)
(1)Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O(2分)
(2)打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹(2分)
(3)BaSO4(1分) 还原性(1分)
(4)观点1:SO2和Fe3+、酸性条件下NO3-都反应(2分)
①SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+(2分;可分两步写,各1分)
②c(2分)
试题分析:(1)装置A中的反应是制取SO2,方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O。
(2)反应前要充入N2,排除装置A中的空气,反应对实验的干扰。
(3)硝酸具有氧化性,白色沉淀为BaSO4,说明SO2具有还原性。
(4)经过分析,各个观点,得出观点1是SO2和Fe3+、酸性条件下NO3-都反应。
①Fe3+把SO2氧化,离子方程式是SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+。
②Fe(NO3)3中有Fe3+,a错;NO3-在酸性条件下有氧化性,b错。故选c。2制备 Fe3+、NO3-的氧化性
点评:本题考查的是SO2制备和Fe3+、NO3-的氧化性的相关知识,题目难度较大,要求学生熟悉所实验的内容及原理,能够考查同学们进行分析问题、解决问题的能力。

练习册系列答案
相关题目