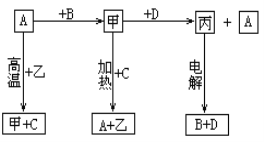
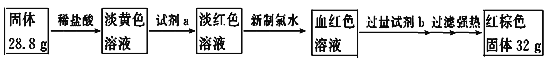
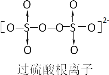
题目内容
【题目】下列有关物质分类和氧化还原的描述正确的是( )
A.酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系
B.元素的单质可由氧化或还原含该元素的化合物来制得
C.得电子越多的氧化剂,其氧化性就越强;含最高价元素的化合物一定具有强的氧化性
D.烧碱、熟石灰均属于碱,酸、碱、盐之间发生的反应均属于复分解反应
【答案】B
【解析】
A项、酸性氧化物不一定是非金属氧化物,如Mn2O7属于酸性氧化物,故A错误;
B项、游离态可由化合态被氧化或被还原得到,如H2+CuO![]() H2O+Cu,MnO2+4HCl(浓)
H2O+Cu,MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,故B正确;
MnCl2+Cl2↑+2H2O,故B正确;
C项、氧化性的强弱不能由得电子的多少来比较,故C错误;
D项、酸、碱、盐之间可以是复分解反应,也可以是氧化还原反应,如硝酸和氢氧化亚铁的反应属于氧化还原反应,故D错误;
故选B。

【题目】根据下表中实验操作、现象得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向饱和Na2CO3溶液中加入BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸 | 产生气泡 | Ksp(BaCO3)<Ksp(BaSO4) |
B | 向FeCl3溶液中滴加NaI溶液,然后滴加CCl4,振荡并静止 | 有机层出现紫 红色 | 氧化性:Fe3+>I2 |
C | 向Na2CO3溶液中滴加盐酸,将产生的气体通入硅酸钠溶液 | 溶液中出现白色沉淀 | 非金属性:Cl>C>Si |
D | 将碳与浓硫酸共热产生的气体通入酸性KMnO4溶液 | 溶液紫红色褪去 | SO2具有漂白性 |
A. A B. B C. C D. D
【题目】利用含铬废料(主要含 Cr2O3,还含有 FeO、SiO2、Al2O3 等杂质)制备重铬酸钠,实现清洁化工生产,工艺流程如图:
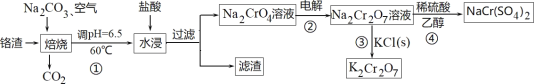
回答下列问题:
(1)焙烧 Cr2O3 转化为Na2CrO4 的化学反应方程式是_____;
(2)实验室模拟此工业流程①,控制反应温度 60℃的方法是_____;
(3)流程②用石墨做电极电解 Na2CrO4 溶液,制备Na2Cr2O7,其原理如图所示,a 是_____极;电极Ⅱ的电极反应式是_____;当生成 2mol Na2Cr2O7时,电路中转移的电子_____mol;
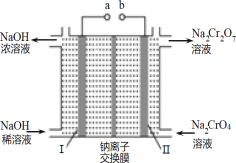
(4)由下图和下表中的溶解度变化,流程③制备 K2Cr2O7,应先充分加热,然后_____反应才能顺利进行;

重铬酸钠的溶解度表:
温度℃ | 10 | 20 | 40 | 60 | 80 | 100 |
溶解度% | 61.6 | 62.8 | 65.1 | 71.8 | 78.7 | 81.1 |
(5)为进一步减少制得的 K2Cr2O7 晶体中 NaCl 等杂质,应再进行_____操作;
(6)流程④Na2Cr2O7 溶液与乙醇反应,乙醇可能被氧化为_____(写一种即可)。