题目内容
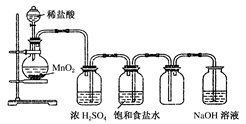
某兴趣小组根据镁与沸水的反应推测镁也能与饱和碳酸氢钠溶液反应。资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。该兴趣小组设计了如下实验方案并验证产物、探究反应原理。
实验1:用砂纸擦去镁条表面氧化膜,将其放人盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
(1)提出假设
该同学对反应中产生的白色不溶物作出如下假设:
假设1:可能为 。
假设2:可能为MgCO3。
假设3:可能是碱式碳酸镁[xMgCO3·yMg(OH)2]
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 预期现象和结论 |
| 实验II | 将实验I中收集到的气体点燃 | |
| 实验III | 取实验I中的白色不溶物,洗涤,加入足量 | ; 白色不溶物可能含有MgCO3 |
| 实验IV | 取实验I中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀;溶液中存在 离子 |
(3)设计定量实验确定实验I的产物:称取实验I中所得干燥、纯净的白色不溶物31.0 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入盛有足量浓硫酸的洗气瓶A、盛有足量碱石灰的干燥管B和盛有足量碱石灰的干燥管C中。实验前后装置A增重1.8 g,装置B增重13.2 g,试确定白色不溶物的化学式 。
(4)请结合化学用语和化学平衡移动原理解释Mg和NaHCO3溶液反应产生大量气泡的原因 。
(16分)
(1)Mg(OH)2(2分)
(2)(每空2分)序号 实验操作 预期现象和结论 实验II 能安静燃烧、产生淡蓝色火焰;气体成分为氢气 实验III 稀盐酸(合理均可) 产生气泡,沉淀全部溶解 实验IV 溶液中存在CO32-
(3)3MgCO3?Mg(OH)2[或Mg(OH)2?3MgCO3或Mg4(OH)2(CO3)3](3分)
(4)NaHCO3溶液中存在如下平衡:HCO3- H++ CO32-、H2O
H++ CO32-、H2O H++OH-;Mg和H+反应生成H2和Mg2+,Mg2+和OH-、CO32-生成难溶物Mg(OH)2?3MgCO3,则H+、OH-、CO32-的浓度均降低,促使上述两平衡均向右移动,故Mg与饱和NaHCO3溶液反应产生大量H2(3分)
H++OH-;Mg和H+反应生成H2和Mg2+,Mg2+和OH-、CO32-生成难溶物Mg(OH)2?3MgCO3,则H+、OH-、CO32-的浓度均降低,促使上述两平衡均向右移动,故Mg与饱和NaHCO3溶液反应产生大量H2(3分)
解析试题分析:(1)根据已经提出的两个假设推导,碳酸镁、碱式碳酸镁、氢氧化镁都是白色不溶物,由此可以得出假设1,反应中产生的白色不溶物可能是氢氧化镁;(2)实验II:镁与沸水发生置换反应,生成氢氧化镁和氢气;由此推断氢前活泼金属镁与饱和碳酸氢钠溶液反应放出的气体可能是氢气,如果实验I中收集的气体点燃时能安静燃烧、产生淡蓝色火焰,则该气体成分为氢气;实验III:碳酸镁不溶于水,但是碳酸的酸性比盐酸或稀硫酸或稀硝酸或醋酸弱,如果实验I中的白色不溶物洗涤排除碳酸氢钠干扰后,加入足量的盐酸或稀硫酸或稀硝酸或醋酸,固体完全溶解,产生气泡,说明白色不溶物可能含有碳酸镁;实验IV:由于碳酸氢钠不能与氯化钙反应,碳酸根离子与氯化钙溶液反应产生白色沉淀,则实验I中的澄清液中加入少量氯化钙稀溶液,产生白色沉淀,说明溶液中含有碳酸根离子;(3)浓硫酸具有吸水性,其增加的质量就是分解产物水的质量,碱石灰不仅有吸水性,而且能吸收二氧化碳,其增加的质量为分解产物二氧化碳的质量;由于水、二氧化碳的相对分子质量分别为18、44,n=m/M,则H2O、CO2的物质的量分别为0.1mol、0.3mol,前者所含氢原子的物质的量为0.2mol,后者所含碳原子为0.3mol,根据氢、碳原子守恒可知不溶物中氢、碳原子物质的量之比为0.2∶0.3=2∶3,由于物质的量之比等于化学式中氢、碳原子个数之比,则氢氧化镁与碳酸镁的系数之比为1∶3,则不溶物的化学式为Mg(OH)2?3MgCO3 [或3MgCO3?Mg(OH)2或Mg4(OH)2(CO3)3];(4)NaHCO3溶液中存在如下平衡:HCO3- H++ CO32-、H2O
H++ CO32-、H2O H++OH-;Mg和H+反应生成H2和Mg2+,Mg2+和OH-、CO32-生成难溶物Mg(OH)2?3MgCO3,则H+、OH-、CO32-的浓度均降低,促使上述两平衡均向右移动,故Mg与饱和NaHCO3溶液反应产生大量H2。
H++OH-;Mg和H+反应生成H2和Mg2+,Mg2+和OH-、CO32-生成难溶物Mg(OH)2?3MgCO3,则H+、OH-、CO32-的浓度均降低,促使上述两平衡均向右移动,故Mg与饱和NaHCO3溶液反应产生大量H2。
考点:考查探究实验和综合计算,涉及反应产生白色不溶物成分的假设、设计反应产生气体的检验方案、设计检验碳酸镁存在的实验方案、设计检验碳酸根离子的方案、数据处理、质量、摩尔质量、物质的量、物质的量在物质组成关系式中的应用、确定白色不溶物的化学式、用化学平衡移动原理解释Mg和NaHCO3溶液反应产生大量气泡的原因等。

 发散思维新课堂系列答案
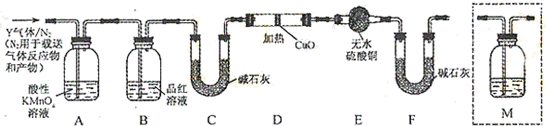
发散思维新课堂系列答案铁在冷的浓硫酸中能发生钝化现象。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。
(1)证明反应所产生的气体中有SO2生成的现象是 。
(2)证明气体中含有氢气的实验现象是 。
(3)为了进一步探究反应后A溶液中铁元素的价态,他们进行了如下的假设:
假设1:溶液中铁元素既有Fe3+也有Fe2+
假设2:溶液中铁元素只有Fe3+
假设3:溶液中铁元素只有________________
基于假设1,现有试剂:0.01 mol/L酸性KMnO4溶液、稀溴水溶液、0.1 mal/L KI溶液、
淀粉溶液、KSCN溶液,蒸馏水。请探究其所得溶液。请完成表中内容。
【实验探究】
| 实验操作 | 预期现象 | 结论 |
| 取反应后的A溶液分装在a、b两试管,步骤①:往a试管中滴入 。 | | |
| 步骤②:往b试管中滴入 。 | | 溶液含有Fe3+ |
根据镁与二氧化碳的反应推测,钠也能在二氧化碳中燃烧,且固体产物可能为碳酸钠、氧化钠、碳中的两种或三种。某兴趣小组对钠在二氧化碳中燃烧后的产物进行定性和定量探究。
(1)假设产物为Na2CO3、Na2O和C的混合物,设计实验方案,验证其中的Na2CO3和Na2O。在答题卡上写出实验步骤、预期现象和结论。(已知室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、BaCl2溶液、Ba(OH)2溶液、精密pH试纸(精确至0.1)、烧杯、试管、滴管、玻璃棒、表面皿、比色卡
| 实验操作 | 预期现象和结论 |
| 步骤1:取适量产物样品于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,取上层清液备用。 | 有不溶的黑色固体。 |
| 步骤2:取适量步骤1清液于试管中, | |
| 步骤3: | |
(2)假设产物为Na2CO3、Na2O和C的混合物,为进一步测定产物中Na2CO3的含量,进行了以下实验:
步骤1:准确称取w克试样,溶解、过滤后准确配制成250mL溶液。
步骤2:准确量取25.00mL所配溶液于锥形瓶中,滴加几滴指示剂A,滴加c mol/L的标准盐酸至溶液的pH约为8.2(碳的主要存在形式为HCO3―),消耗盐酸的体积为V1mL;再滴加几滴甲基橙,继续用上述盐酸滴至溶液由黄色变橙色,消耗盐酸的体积为V2mL。
步骤3:重复实验3次。滴定结果如下
| 滴定 次数 | 待测溶液 的体积/mL | 消耗标准盐酸的体积 | |
| V1/mL | V2/mL | ||
| 1 | 25.00 | 15.02 | 4.97 |
| 2 | 25.00 | 14.98 | 5.03 |
| 3 | 25.00 | 13.21 | 6.75 |
①步骤2中,第一步滴定所使用的A指示剂为 ,滴定终点的现象为 。
②计算Na2CO3的质量分数= (用含w、c的代数式表示)
化学与科技、生产、生活密切相关。下列说法正确的是( )
| A.气象环境报告中的“PM2.5”是对一种新分子的描述 |
| B.高铁车厢采用的铝合金材料强度大、质量轻,不与氧气反应 |
| C.“玉兔号”月球车太阳能电池帆板的材料是二氧化硅 |
| D.地沟油的主要成分是油脂,其组成与汽油、煤油不相同 |