题目内容
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式: __________________________ 、
_________________________________ 。
(2)根据甲同学设计的实验及现象不能证明是乙炔与溴发生了加成反应,其理由是 _______
(a)使溴水褪色的反应,未必是加成反应 (b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔 (d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是 ,它与溴水反应的离子方程式是 ;在验证过程中必须全部除去。
(4)为验证此反应是加成而不是取代,丙同学用pH试纸来测试反应后溶液的酸性,理由是 。
(12分)(1)CaC2+2HO2→C2H2↑+Ca(OH)2 HC≡CH+Br2→CHBr=CHBr (各2分,共4分)
(2)a、c (2分)
(3)H2S Br2+H2S =S↓+2H++2Br- (各2分,共4分)
(4)若发生取代反应必生成HBr,溶液酸性将明显增强,故可用pH试纸验证。 (2分)
解析试题分析:(1)碳化钙能与水反应生成乙炔和氢氧化钙,反应的化学方程式为CaC2+2H2O Ca(OH)2+C2H2↑。乙炔含有碳碳三键,能与溴水发生加成反应而使溴水褪色,反应的化学方程式为CH≡CH+2Br2
Ca(OH)2+C2H2↑。乙炔含有碳碳三键,能与溴水发生加成反应而使溴水褪色,反应的化学方程式为CH≡CH+2Br2 CHBr2-CHBr2。
CHBr2-CHBr2。
(2)生成的乙炔中混有硫化氢气体,可与溴水发生氧化还原反应而使溴水褪色,所以使溴水褪色的反应,未必是加成反应,也不一定是乙炔,所以正确的答案ac。
(3)褪色后的溶液里有少许淡黄色浑浊,该沉淀应该是单质S。这是由于电石中含有硫化物,与水反应生成硫化氢气体,硫化氢气体具有还原性,能与溴水发生氧化还原反应生成硫和溴化氢,反应的离子方程式为Br2+H2S =S↓+2H++2Br-。
(4)因为若发生取代反应必生成HBr,溶液酸性将明显增强,故可用pH试纸验证。
考点:考查乙炔的制备和性质实验
点评:该题是高考中的常见题型,属于中等难度的试题。试题紧扣教材,以乙炔的制备为载体,重点考查学生的实验分析、探究能力,有利于调动学生的学习兴趣,激发学生的学习积极性,也有利于培养学生的逻辑思维能力和抽象思维能力。本题中应注意乙炔的除杂和性质实验,注意与溴水反应的性质。

 名校课堂系列答案
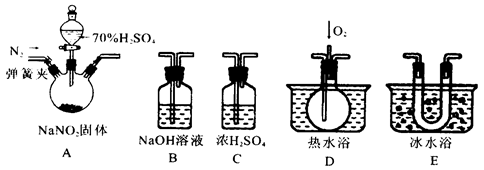
名校课堂系列答案(16分)某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究。
(1)装置A中发生反应的化学方程式
是_______,装置B的作用是_______。
设计装置C的目的是验证SO2的
_______________性,D中NaOH全部转化为
NaHSO3的标志是____________。
(3)反应结束时烧瓶中Cu有剩余,某
同学认为H2SO4也有剩余,他设计了下列实
验方案来测定剩余H2SO4的量。经冷却,定
量稀释后进行下列实验,能达到目的是________(填序号);
a. 用酸碱中和滴定法测定 b. 与足量Zn反应,测量生成H2的体积
c. 用PH计测溶液PH值 d. 与足量BaCl2溶液反应,称量生成沉淀的质量
(4)向D瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 滴加少量淀粉碘化钾溶液,振荡 | | III |
| ② | 滴加少量棕红色的KI3溶液,振荡 | | II |
| ③ | 滴入加少量酸性KMNO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 | |
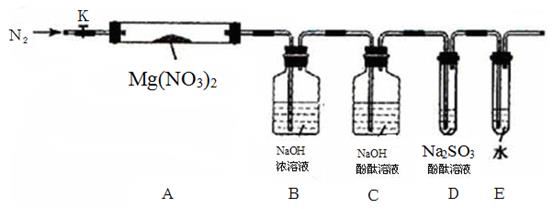
某兴趣小组根据镁与沸水的反应推测镁也能与饱和碳酸氢钠溶液反应。资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。该兴趣小组设计了如下实验方案并验证产物、探究反应原理。
实验1:用砂纸擦去镁条表面氧化膜,将其放人盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
(1)提出假设
该同学对反应中产生的白色不溶物作出如下假设:
假设1:可能为 。
假设2:可能为MgCO3。
假设3:可能是碱式碳酸镁[xMgCO3·yMg(OH)2]
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 预期现象和结论 |
| 实验II | 将实验I中收集到的气体点燃 | |
| 实验III | 取实验I中的白色不溶物,洗涤,加入足量 | ; 白色不溶物可能含有MgCO3 |
| 实验IV | 取实验I中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀;溶液中存在 离子 |
(3)设计定量实验确定实验I的产物:称取实验I中所得干燥、纯净的白色不溶物31.0 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入盛有足量浓硫酸的洗气瓶A、盛有足量碱石灰的干燥管B和盛有足量碱石灰的干燥管C中。实验前后装置A增重1.8 g,装置B增重13.2 g,试确定白色不溶物的化学式 。
(4)请结合化学用语和化学平衡移动原理解释Mg和NaHCO3溶液反应产生大量气泡的原因 。
某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理论述中正确的是( )
| A.镁粉只直接与溴水中的溴反应 |
| B.镁粉只与溴水中的酸反应 |
| C.产生极少量的气泡是由于镁粉与水反应得到 |
| D.镁粉在水的催化下与溴发生反应 |


 与I-发生反应5I-+IO
与I-发生反应5I-+IO