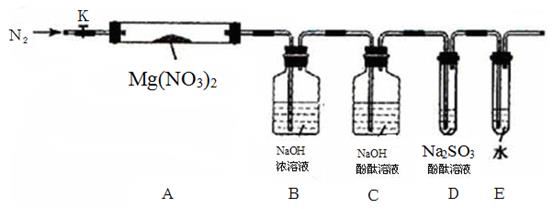
题目内容
根据镁与二氧化碳的反应推测,钠也能在二氧化碳中燃烧,且固体产物可能为碳酸钠、氧化钠、碳中的两种或三种。某兴趣小组对钠在二氧化碳中燃烧后的产物进行定性和定量探究。
(1)假设产物为Na2CO3、Na2O和C的混合物,设计实验方案,验证其中的Na2CO3和Na2O。在答题卡上写出实验步骤、预期现象和结论。(已知室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、BaCl2溶液、Ba(OH)2溶液、精密pH试纸(精确至0.1)、烧杯、试管、滴管、玻璃棒、表面皿、比色卡
| 实验操作 | 预期现象和结论 |
| 步骤1:取适量产物样品于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,取上层清液备用。 | 有不溶的黑色固体。 |
| 步骤2:取适量步骤1清液于试管中, | |
| 步骤3: | |
(2)假设产物为Na2CO3、Na2O和C的混合物,为进一步测定产物中Na2CO3的含量,进行了以下实验:
步骤1:准确称取w克试样,溶解、过滤后准确配制成250mL溶液。
步骤2:准确量取25.00mL所配溶液于锥形瓶中,滴加几滴指示剂A,滴加c mol/L的标准盐酸至溶液的pH约为8.2(碳的主要存在形式为HCO3―),消耗盐酸的体积为V1mL;再滴加几滴甲基橙,继续用上述盐酸滴至溶液由黄色变橙色,消耗盐酸的体积为V2mL。
步骤3:重复实验3次。滴定结果如下
| 滴定 次数 | 待测溶液 的体积/mL | 消耗标准盐酸的体积 | |
| V1/mL | V2/mL | ||
| 1 | 25.00 | 15.02 | 4.97 |
| 2 | 25.00 | 14.98 | 5.03 |
| 3 | 25.00 | 13.21 | 6.75 |
①步骤2中,第一步滴定所使用的A指示剂为 ,滴定终点的现象为 。
②计算Na2CO3的质量分数= (用含w、c的代数式表示)
(1)
| 实验操作 | 预期现象与结论 |
| 步骤2:滴加足量的BaCl2溶液,充分振荡,静置,取上层清液于另外一支试管备用 | 有白色沉淀生成,说明产物中有Na2CO3 |
| 步骤3:将一片精密PH试纸置于表面皿上,用玻璃棒蘸取步骤2上层清液点在精密PH试纸上,待颜色稳定后,对照比色卡读出数据。 | 溶液的PH明显大于9.6,说明产物中含有Na2O |
(2)①酚酞 由浅红色变为无色,且半分钟不变色
②5.3c/w×100%
解析试题分析:(1)Na2O+H2O=2NaOH,NaOH和Na2CO3都能与稀盐酸反应,因此不能滴加稀盐酸;Na2CO3与BaCl2、Ba(OH)2是都能反应生成白色沉淀,但是后者会引入NaOH,干扰产物中Na2O的检验,因此步骤2中只能滴加足量BaCl2溶液;充分振荡,有白色沉淀生成,说明产物中存在Na2CO3;静置,取上层清液于另外一支试管备用;由于室温时BaCO3饱和溶液的pH=9.6,如步骤2的上层清液中混有NaOH,则其pH>9.6,因此步骤3中应将一片精密pH试纸置于表面皿上,用玻璃棒蘸取步骤二上层清液点在精密pH试纸上,待颜色稳定后,对照比色卡读出数据,若溶液pH明显大于9.6说明产物中含有Na2O;(2)①步骤2中第一步滴定终点的pH约为8.2,刚好在酚酞的pH变色范围,因此选择酚酞作指示剂,当待测的碱性溶液由浅红色变成无色,且半分钟内不变色,这是滴定终点的现象,就停止滴定;②第3次滴定所得数据存在明显的误差,应舍去;根据第1、2次滴定所得体积计算平均体积,则V1=(15.02+14.98)mL/2=15.00mL,V2=(4.97+5.03)mL/2=5.00mL;由于第1次滴定时先后发生反应为NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaHCO3+NaCl,则n(HCl)=n(NaOH)+n(Na2CO3)=cmol/L×15.00×10—3L、n(Na2CO3)=n(NaHCO3);第2次滴定时只发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,则n(HCl)=n(NaHCO3)=cmol/L×5.00×10—3L,所以n(Na2CO3)= n(NaHCO3)=cmol/L×5.00×10—3L,n(NaOH)= cmol/L×15.00×10—3L—cmol/L×5.00×10—3L = cmol/L×10.00×10—3L;式样中n(Na2CO3)=cmol/L×5.00×10—3L×250mL/25.00mL,n(NaOH)= cmol/L×10.00×10—3L×250mL/25.00mL;式样中m(Na2CO3)=cmol/L×5.00×10—3L×250mL/25.00mL×106g/mol,w(Na2CO3)=cmol/L×5.00×10—3L×250mL/25.00mL×106g/mol÷wg×100%=5.3c/w×100%。
考点:考查探究实验和测定产物中某一成分纯度的定量实验,包括检验产物中有关成分的实验方案的设计、酸碱中和滴定指示剂的选择、滴定终点的现象、滴定数据的处理与计算、质量分数的计算等问题。

目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境。这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验。
【实验Ⅰ】 硫的质量确定: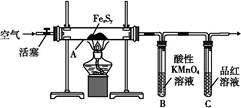
按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.0 g铁硫簇结构(含有部分不反应的杂质),在试管B中加入50 mL 0.1 mol·L-1的酸性KMnO4溶液,在试管C中加入品红溶液。通入空气并加热,发现固体逐渐转变为红棕色。待固体完全转化后将B中溶液转移至250 mL容量瓶,洗涤试管B后定容。取25.00 mL该溶液用0.01 mol·L-1的草酸(H2C2O4)进行测定剩余KMnO4溶液浓度的滴定。记录数据如下:
| 滴定次数 | 待测溶液 体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
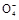 +2H2O+5SO2
+2H2O+5SO2 2Mn2++5S
2Mn2++5S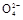 +4H+
+4H+②2Mn
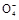 +6H++5H2C2O4
+6H++5H2C2O4 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O【实验Ⅱ】 铁的质量确定:
将实验Ⅰ硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.6 g固体。
试回答下列问题:
(1)检查“实验Ⅰ”中装置气密性的方法是 。
(2)滴定终点的判断方法是 。
(3)试管C中品红溶液的作用是 。
有同学提出,撤去C装置,对实验没有影响,你的看法是 (选填“同意”或“不同意”),理由是 。
(4)根据实验Ⅰ和实验Ⅱ中的数据可确定该铁硫簇结构的化学式为 。
【问题探究】 滴定过程中,细心的小明发现该KMnO4颜色褪去的速率较平常滴定时要快得多。为研究快的原因,甲同学继续进行了下列实验,实验数据如下表:
| 编号 | 温度/℃ | 酸化的H2C2O4 溶液/mL | KMnO4 溶液/mL | 溶液褪 色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另加少量可溶 于水的MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
(5)分析上述数据,滴定过程中反应速率较快的一种可能原因是 。
某兴趣小组根据镁与沸水的反应推测镁也能与饱和碳酸氢钠溶液反应。资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。该兴趣小组设计了如下实验方案并验证产物、探究反应原理。
实验1:用砂纸擦去镁条表面氧化膜,将其放人盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
(1)提出假设
该同学对反应中产生的白色不溶物作出如下假设:
假设1:可能为 。
假设2:可能为MgCO3。
假设3:可能是碱式碳酸镁[xMgCO3·yMg(OH)2]
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 预期现象和结论 |
| 实验II | 将实验I中收集到的气体点燃 | |
| 实验III | 取实验I中的白色不溶物,洗涤,加入足量 | ; 白色不溶物可能含有MgCO3 |
| 实验IV | 取实验I中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀;溶液中存在 离子 |
(3)设计定量实验确定实验I的产物:称取实验I中所得干燥、纯净的白色不溶物31.0 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入盛有足量浓硫酸的洗气瓶A、盛有足量碱石灰的干燥管B和盛有足量碱石灰的干燥管C中。实验前后装置A增重1.8 g,装置B增重13.2 g,试确定白色不溶物的化学式 。
(4)请结合化学用语和化学平衡移动原理解释Mg和NaHCO3溶液反应产生大量气泡的原因 。
(14分)正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下: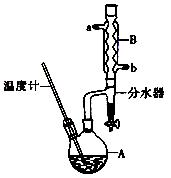
2CH3CH2CH2CH2OH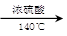 (CH3CH2CH2CH2)2O + H2O
(CH3CH2CH2CH2)2O + H2O
反应物和产物的相关数据如下
| | 相对分子质量 | 沸点/℃ | 密度(g/cm3) | 水中溶解性 |
| 正丁醇 | 74 | 117.2 | 0.819 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成反应:
①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
③待A中液体冷却后将其缓慢倒入盛有70 mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3 g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11 g。
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为 。
(2)加热A前,需先从____(填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去 ,振摇后静置,粗产物应从分液漏斗
的 (填“上”或“下”)口分离出。
(4)步骤④中最后一次水洗的目的是 。
(5)步骤⑤中,加热蒸馏时应收集 (填选项字母)左右的馏分。
a.100℃ h. 117℃ c. 135℃ d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为____,下层液体的主要成分为 。
(7)本实验中,正丁醚的产率为 。
化学与生活、社会密切相关。下列说法不正确的是
| A.铁强化酱油可通过膳食补充人体所需的铁元素 |
| B.地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成生物柴油,生物柴油成分与从石油中提取的柴油成分不同 |
| C.近期媒体报道的某白酒中的增塑剂是对人体健康有害的物质 |
| D.汽车尾气中的CO、NO等都是汽油和柴油的不完全燃烧产物 |
化学与生活密切相关。下列说法不正确的是
| A.乙烯可作水果的催熟剂 |
| B.硅胶可作袋装食品的干燥剂 |
| C.福尔马林可作食品的保鲜剂 |
| D.氢氧化铝可作胃酸的中和剂 |
下列广告语对应商品中含有的物质有误的是
| A.“红梅味精,领先(鲜)一步 ”——蛋白质 |
| B.“衡水老白干,喝出男人味”——乙醇 |
| C.“吃了钙中钙,腰不疼了,腿不痛了,腰杆也直了”——碳酸钙 |
| D.“要想皮肤好,早晚用大宝”——丙三醇 |