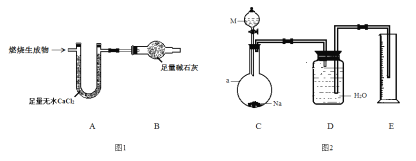
题目内容
【题目】A、B、C均为单质,其中A为用途广泛的金属单质,B为黄绿色气体,B与C反应后的产物E溶于水得无色酸性溶液。A、B、C之间的其他反应如图所示。
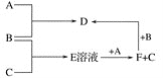
试填空:
(1)写出下列物质的化学式:
B________,D________,F________。
(2)鉴别D溶液中阳离子的方法是________________________。
(3)写出下列反应的离子方程式:
①A+E→F+C:____________________________________________________。
②B+F→D:________________________________________________。
【答案】Cl2 FeCl3 FeCl2 取少量D溶液于试管中,然后滴加KSCN溶液,溶液呈红色表明含Fe3+ Fe+2H+===Fe2++H2↑ 2Fe2++Cl2===2Fe3++2Cl-
【解析】
由“B为黄绿色气体 ”知B为氯气;由“B与C反应后的产物E溶于水得无色酸性溶液”知E为HCl,进而可知C为H2 ;
由“E+A→F+C,即 HCl+A→F+H 2 ” 知A为金属单质且F为盐;由“A+B→D,即A+Cl2→D” 知D为盐;
再由 “F+B→D,即 F+Cl2→D”知D 、F中A元素的化合价不同,即A为变价金属,可考虑A为铁,D为 FeCl3,F为FeCl2。
(1)由以上分析可知B为:Cl2、D为 FeCl3、F为FeCl2,
故答案为:Cl2 ; FeCl3 ;FeCl2 ;
(2)D溶液为FeCl3溶液,其阳离子为Fe3+,能与KSCN溶液反应,使溶液呈红色,
故答案为:取少量D溶液于试管中,然后滴加KSCN溶液,溶液呈红色表明含Fe3+ ;
(3)①A为Fe,E为HCl,二者反应生成氯化亚铁和氢气,离子方程式为:Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑;
②B为氯气,F为氯化亚铁,二者反应生成氯化铁,离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-。